Artemia salina como organismo bioindicador para metales pesados
Artemia salina as a bioindicator for heavy metals
Daniela Maza Vega María Jimena Prieto Nadia Silvia Chiaramoni Silvia Del Valle AlonsoLa ecotoxicología surge como una visión antropocéntrica del ambiente y trata de explicar las relaciones entre las diferentes partes del ambiente, las toxinas y el hombre. La evaluación más común de la toxicidad es la medición de la letalidad a corto plazo, como se hace con frecuencia en toxicología humana. Uno de los principales objetivos de la ecotoxicología es relacionar la cantidad de sustancia tóxica a la que están expuestos los organismos con la naturaleza y magnitud del daño que se les produce. Existen diferentes formas de evaluar la toxicidad, generalmente la variable más utilizada es la mortalidad de los individuos. Por esa razón, la determinación del valor de la concentración de sustancias a las que el 50% de los organismos mueren en un determinado período de tiempo (CL50) es una práctica común como un paso inicial para evaluar la toxicidad de productos químicos. En estudios de toxicidad regulatoria, normalmente llevados a cabo en instalaciones certificadas bajo Buenas Prácticas de Laboratorio (BPL), se evalúa la toxicidad aguda de productos químicos en peces, crustáceos y/o algas siguiendo los métodos indicados en las Directrices de la Organización para la Cooperación y el Desarrollo Económico (OCDE) (Pillai, 2023).
En el caso de los metales pesados, son esenciales para la actividad biológica en concentraciones mínimas. En cambio, concentraciones mayores o menores podrían provocar efectos tóxicos o deficiencias, respectivamente, por lo que es importante evaluar este tipo de parámetros.
Artemia spp. son microcrustáceos de cuerpo blando, de color marrón anaranjado y transparentes a la luz; pertenecen al phylum Arthropoda, clase Crustacea, subfilo Branchiopoda. Son comúnmente conocidos con el nombre de camarones de salmuera.
Estas especies se encuentran en todo el mundo en aguas de alta salinidad, pueden crecer a temperaturas entre 6 y 35ºC. Las hembras producen huevos que, en condiciones externas favorables, eclosionan produciendo larvas de aproximadamente 1 mm de tamaño. Los huevos también pueden formar quistes y permanecer en esta forma por un año o más (Pino Pérez & Jorge Lazo, 2010; Sarah et al., 2017).
Artemia spp. tiene también la ventaja de ser más rápido para eclosionar (24 horas), barato y simple de manejar (no se requieren técnicas asépticas). Se puede usar fácilmente una gran cantidad de organismos para la validación estadística, no se requiere equipo especial y se usan pequeñas cantidades de muestras (2-20 mg o menos).
Existe una tendencia a utilizar Artemia spp para pruebas toxicológicas y ecotoxicológicas debido a su rapidez, conveniencia y bajo costo. La prueba propuesta por Michael y colaboradores en 1956 fue la primera y posteriormente adoptada por muchos laboratorios como método preliminar para estimar la toxicidad (Michael et al., 1956).
Esta técnica requiere poca experiencia y no consume mucho tiempo, sin embargo, la sensibilidad del ensayo fue relativamente baja, resultado que estuvo relacionado con la cepa y los compuestos de referencia utilizados en este estudio. El resultado obtenido permitió establecer que este bioensayo es un instrumento valioso como prueba en una primera evaluación para categorizar la toxicidad de productos químicos. En este trabajo, usamos Artemia salina para desarrollar un modelo de evaluación de los niveles de metales pesados en el agua.
Los organismos utilizados en todas las pruebas fueron Artemia salina sp. Para la eclosión, se incubaron quistes de artemia comercial Vita Fish (1 g en 1 L) en agua mineral acondicionada con un ciclo de luz-oscuridad de 16-8 h y aireación constante a una temperatura de 27 ± 1 °C durante 48 h (Kumar et al., 2012; Miguel et al., 2021) con un reemplazo del medio cada 24 h de incubación.
Para ello, se utilizó un embudo de separación de vidrio de 1 L y un aireador RS Electrical RS-290 (Zhongshan, China) para proporcionar oxígeno. La incubación se realizó en una incubadora de calor/frío Semedic I-291PF (INGELAB). Como medio de incubación se utilizó agua mineral comercial suplementada con aproximadamente 14 g de sal de cocina (14 g/L). Si bien se recomienda utilizar agua de mar, el agua mineral y corriente son aceptables como agua de mar artificial si están acondicionadas. En el caso del agua corriente, se debe tener en cuenta si ésta presenta cloro (Kumar et al., 2012; Sarah et al., 2017).
Al final de la incubación, la artemia se separó de los huevos no eclosionados en tubos cónicos de 50 mL y se hizo un cambio de medio por agua de dilución con la que se realizaron las pruebas. Este medio consiste en agua del grifo tratada con anticloruro Aquapur 1mL/L y suplementada con la misma cantidad de NaCl que el medio de incubación.
Se colocaron Artemias jóvenes, menos de 24 h al comienzo de la prueba, en placas de 24 pocillos y se expusieron a la sustancia de prueba en un rango de concentración durante un período de 24 h. Se utilizaron entre 10 y 30 artemias por pocillo en un volumen de 1 mL para cada concentración de prueba y controles (Gambardella et al., 2014). Los contenedores no se airearon y los crustáceos no se alimentaron durante la prueba (APAT e IRSA-CNR, 2003).
Las soluciones utilizadas en las diferentes determinaciones fueron: Sulfato de Cobre (CuSO4), Sulfato de Zinc (ZnSO4) y Nitrato de Plomo (Pb(NO3)2) (Tabla 1).

El conteo de artemias vivas y muertas se realizó a las 0 h, 1 h y 24 h y los resultados se comparan con los valores de control, que consisten en artemias sin tratar. Los resultados se analizaron para calcular la CL50 a las 24 h determinada por Análisis Probit de supervivencia (StatPlus 2007 Professional) (Calienni et al., 2017). Este parámetro consiste en la concentración de cada compuesto que causa la muerte del 50% de los organismos en el período dado. Se considera muerta cuando no presenta ningún movimiento interno o externo durante 10 segundos de observación (Tzima et al., 2022). Para cada concentración se evaluaron 6 pocillos. Los resultados obtenidos se compararon con el control sin tratar a los diferentes tiempos.
La medición de la movilidad se realizó con el wMicrotracker (Designplus SRL, Buenos Aires, Argentina) (Simonetta y Golombek, 2007, Shaw et al., 2022). El sistema detecta el movimiento de organismos a través de la interferencia provocada por los mismos en una matriz de micro haces de luz infrarroja durante un periodo de 15 minutos con luz constante a 24 ± 1 °C (temperatura ambiente). La medición se realizó en placas de 24 pocillos a las 0, 1 y 24 h de exposición para cada solución de metal pesado. La actividad de nado está determinada por el número de interrupciones del microhaz infrarrojo para el período mencionado y los valores se relativizan al control sin tratamiento (Calienni et al., 2017). Al igual que en la evaluación con lupa, se analizaron 6 pocillos por cada concentración para determinar cambios en el movimiento. Para ello, se utilizaron entre 30 y 50 artemias por pocillo en 1 ml de volumen final.
La cantidad de artemias y los volúmenes utilizados en los ensayos de movilidad óptica fueron diferentes a los utilizados en el ensayo de toxicidad aguda bajo lupa debido a los objetivos particulares de cada ensayo y la cantidad de artemias requeridas para cada propósito.
En síntesis, las pruebas nos permitieron comprobar que con un número reducido de artemias (no más de 30), se puede analizar el cambio morfológico en el desarrollo de cada una de ellas y obtener parámetros de viabilidad y mortalidad. Ante un número elevado de artemias (superior a 30), utilizamos el WMicrotracker para relacionar la variación de movimiento registrada con los efectos letales y subletales de la prueba de toxicidad y, evaluar la población en lugar de cada individuo.
Paralelamente a la evaluación con lupa, se registraron las morfologías desarrolladas por cada animal en cada concentración a las 24 h de exposición. Para ello, se fotografiaron 5 animales por cada concentración de cada compuesto y grupo control con una cámara Microsoft LifeCam Studio acoplada a un estereomicroscopio trinocular Nikon SMZ-800 (Nikon Corporation, Tokio, Japón) inmovilizados en carboximetilcelulosa sódica (CMC) (Calienni et al., 2018). La CMC es un polímero que retiene una gran cantidad de agua permitiendo la observación de organismos, en este caso artemias, sin quitar viabilidad.
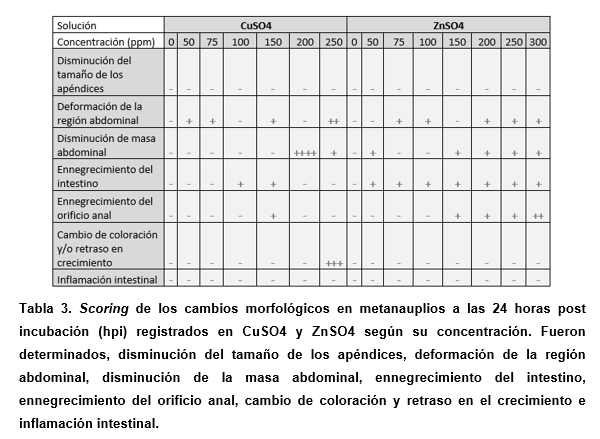
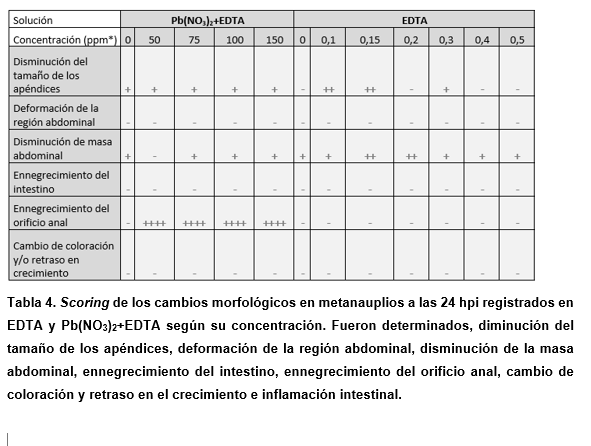
Se evaluó la aparición y frecuencia de los cambios morfológicos encontrados en muestras de artemia analizadas 24 horas después de la exposición al compuesto (Houghton et al., 1978, Ali Saber et al., 2013, Igartúa et al. 2015). Se adaptó el método de puntuación utilizado en peces cebra en Calienni y colaboradores (Calienni et al., 2018). Brevemente, se registraron todos los cambios morfológicos observados comparados con el desarrollo normal de nauplio a metanauplio de artemia, centrándose en aquellos relacionados con el tracto digestivo, ya que se vincula a la bioacumulación, y el tamaño de los apéndices. Dichos cambios fueron: Cambio en la coloración y retardo en el crecimiento, disminución en el tamaño de los apéndices, ennegrecimiento del intestino, inflamación intestinal, ennegrecimiento del orificio anal, disminución en la masa abdominal, deformación de la región abdominal. Para ello, se registraron las artemias que presentaban cambios morfológicos y se calculó el porcentaje con respecto a las artemias totales para cada compuesto según su concentración.
El porcentaje de metanauplios (artemia tras 24 h post incubación) con efectos adversos se puntuó como 80-100 (++++), 60-80 (+++), 30-60 (++), 10-30 (+) y 10-0% (-) (Calienni et al., 2018).
Análisis estadístico
Los resultados son expresados como promedio ± desviación estándar (SD). El análisis estadístico se realizó empleando ANOVA de dos vías y post-test de comparaciones múltiples de Dunnett. Se normalizaron los resultados de cada concentración respecto del valor del tiempo 0 y se compararon los efectos respecto del control sin tratar (concentración 0 mg/L) para cada tiempo. Solo se consideraron valores con p < 0,05 como estadísticamente significativos. Los análisis se realizaron utilizando el software GraphPad Prism 8.0.1 (GraphPad Inc.).
En los resultados obtenidos respecto a la incubación con CuSO4 (Figura 1), no se aprecian cambios significativos en la mortalidad evaluada entre las 0 y 1 h. Sin embargo, a 24 h, se observa una curva de mortalidad del tipo sigmoidea en función de la concentración.
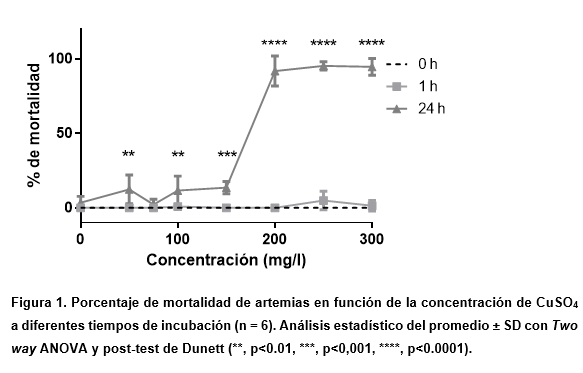
Al analizar la curva obtenida desde el punto de vista poblacional, la importancia de la pendiente podría estar relacionada con la variabilidad intraespecífica (Møller et al., 1996; Sarabia Álvarez, 2002). De esta manera, cuanto más pronunciada sea la pendiente de la curva de toxicidad, más uniforme será la respuesta, como en este caso.
Zinc
Los resultados de la prueba de ZnSO4 se muestran en la Figura 2, donde no se observaron cambios apreciables entre 0 y 1 h, como en el caso del sulfato de cobre, mientras que, a las 24 h, se observó un aumento en la mortalidad de la artemia a medida que se aumentaba la concentración del compuesto probado. Con este compuesto, no se observó la letalidad absoluta de los crustáceos probados en las concentraciones más altas.
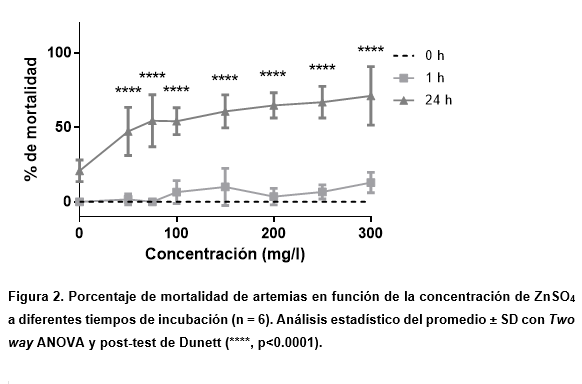
Comparada con la curva obtenida del cobre, el zinc tiene una menor pendiente. Esto, desde el punto de vista poblacional, indicaría una gran variabilidad en la respuesta obtenida (Møller et al., 1996) .
Plomo
Las sales de plomo tienen baja solubilidad en agua, lo que dificultó su determinación en las mismas concentraciones que los otros metales divalentes, ya que se observó precipitación de la sal en las concentraciones más altas a las 24 h de incubación, no pudiendo determinar cuanta sal se encontraba disponible en esos ensayos (no mostrado). Por ello, se utilizó una solución de 100 mM de ácido etilendiaminotetraacético (EDTA) para mantener la solución madre de plomo en fase acuosa.
A diferencia de lo observado en compuestos anteriores, se presentaron cambios significativos entre 0 y 1 h, acercándose a la letalidad absoluta en las concentraciones más altas y obteniendo una curva de mortalidad similar a la observada en CuSO4, mientras que a las 24 h se obtuvo una curva del mismo tipo con un aumento esperado en el porcentaje de muerte en cada concentración (Figura 3). Asimismo, no se observaron cambios significativos con el control en el rango de 50 a 100 mg / L.
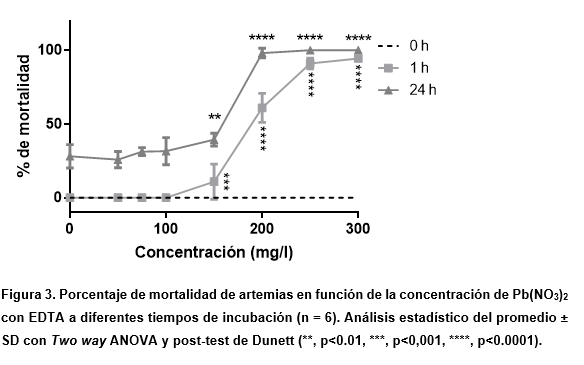
Para confirmar que los resultados obtenidos se deben al metal divalente y no al uso del agente quelante, se realizó una curva de mortalidad con las concentraciones que se utilizaron de EDTA en la prueba anterior. Como se esperaba, no se encontraron efectos letales a 1 h. Esto indicaría que lo observado en el ensayo previo a 1 h podría corresponder a un efecto del plomo, cuya solubilidad se ve aumentada por el efecto del EDTA. Sin embargo, a las 24 h se observó una gran variabilidad en los resultados. Esto puede deberse a la variabilidad de cada artemia en presencia de EDTA en cada concentración, haciendo inevitable la dispersión.
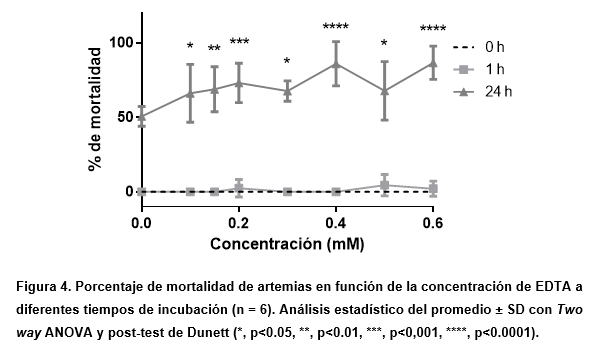
Por esta razón, se probaron concentraciones más bajas (0 – 50 mg/L, no mostrado) que las utilizadas en otros metales divalentes para no exceder la solubilidad del nitrato de plomo. Aunque el precipitado no fue evidente, los resultados obtenidos muestran una alta dispersión, por lo que la CL50 de este metal no pudo ser calculada correctamente.
Desde un punto de vista toxicológico, se asume que la pendiente de la curva de toxicidad representa una respuesta uniforme para todos los organismos de una especie/población, y su forma está relacionada con el mecanismo de toxicidad. Una pendiente poco pronunciada indicaría una absorción lenta, toxicidad retardada o una excreción o desintoxicación rápida. Por el contrario, una pendiente con un valor más alto indicaría una absorción rápida, un efecto rápido o una excreción o desintoxicación lenta (Rand et al., 1995). Desde el punto de vista de la población, está relacionada con la variabilidad intraespecífica, como sugieren Møller et al. (1996), de modo que cuanto más pronunciada sea la pendiente de la curva de toxicidad, más uniforme será la respuesta, mientras que una pendiente más suave indicaría una mayor variabilidad en la respuesta.
Basándose en los resultados obtenidos, la aproximación poblacional para este tipo de curvas es más apropiada, ya que la información que se pretende obtener con el análisis toxicológico requeriría otros tipos de estudios, como aquellos relacionados con la cinética de acumulación y eliminación del metal. Además, desde un enfoque poblacional, según los estudios de Evenden & Depledge (1997), es correcto considerar que la forma sigmoide de la curva indica cómo, en una población de individuos, dosis más bajas de un compuesto causan inicialmente una respuesta solo en los organismos más susceptibles dentro de la población (Evenden & Depledge, 1997). A medida que aumenta la dosis, más individuos responderán y, en dosis altas, solo los individuos más resistentes estarán disponibles para responder (Chilcuit & Tabashnik, 1995; Sarabia Álvarez, 2002).
A partir de lo descrito anteriormente, el efecto del cobre puede explicarse desde una perspectiva poblacional, ya que tiene una curva sigmoide, lo que nos permite aproximarnos a una explicación del efecto de este metal desde el estudio de Evenden & Depledge, mientras que la pendiente menos pronunciada del zinc mostró una respuesta más lenta, pudiendo deberse a la variabilidad intraespecífica de la población que podrá evaluarse en la movilidad y cambios morfológicos a analizar.
Respecto al plomo, podríamos explicar la amplia variabilidad en las concentraciones más altas (125-300, no mostrado) debido a la imposibilidad de saber cuánto plomo estaba soluble durante la precipitación, que ocurrió durante el período de exposición sin lupa. A su vez, las diferencias encontradas en las muestras por debajo del límite de solubilidad podrían explicarse por la resistencia individual al compuesto de cada artemia en un corto período de tiempo. Lo mismo podría explicar el efecto del EDTA sin plomo. En el caso del uso de EDTA para solubilizar plomo, se observa un efecto sigmoide como el cobre, con la diferencia de que este efecto se observa tanto a 1 como a 24 h. Esto mostraría que el enfoque correcto para analizar tanto EDTA como plomo es el poblacional, es decir, que el efecto de ambos depende de las resistencias individuales de cada artemia probada causando una gran variabilidad
Concentración letal 50 (CL50)
Con los datos obtenidos del número de artemias muertas en cada concentración evaluada, se calculó la CL50 del compuesto a las 24 h de incubación mediante el análisis de supervivencia Probit del software StatPlus 5 (Tabla 2). Como se mencionó previamente, no fue posible calcular la CL50 para el plomo ya que las diferentes muestras presentaron una desviación alta debido a la baja solubilidad del plomo.
Al solubilizar los cationes utilizando EDTA, se incorporó un nuevo compuesto al sistema, siendo necesario evaluarlo por separado. Como no era el objetivo de nuestro trabajo, los datos de CL50 para el plomo no se compararon con los de zinc y cobre, sino que la CL50 para el plomo solubilizado con EDTA se incorporó a la tabla.

Convencionalmente, un parámetro apropiado para expresar toxicidad es el CL50 aunque, cabe aclara, que sus valores no expresan los efectos menos severos anteriores a los resultantes por muerte (Falope, 1995). Entre los ensayos conductuales subletales, se ha encontrado que las alteraciones en la locomoción son un punto final sensible que se investiga con frecuencia (Morgana et al., 2018). Una solución a esta cuestión fue el desarrollo de un nuevo método óptico que mide la movilidad de las larvas de Artemia para obtener resultados más precisos y biológicamente definidos. En 1985, Schmidt determinó la inhibición de la motilidad larval en lugar de su letalidad (Schmidt, 1985). La actividad de los animales se mide utilizando un contador óptico de motilidad. El cálculo se consideró a partir del número de interrupciones del haz de luz en 10 segundos. Se trata de un procedimiento menos tedioso que el utilizado con microscopio óptico. Incluso con este método se detectan los pequeños daños de los organismos en relación a la movilidad y por tanto, las pequeñas cantidades de toxinas. Además, se sabe que las artemias son altamente fototácticas, y las perturbaciones en su movilidad pueden ser inducidas por el uso de luz intensa. De este modo, se utiliza una luz menos estresante, por ejemplo la luz infrarroja, para determinar la cantidad de movimiento con mínima interferencia durante todo el test (Choi et al., 2018; Ñañez Pacheco et al., 2021). La principal desventaja relacionada con esta variante experimental es que requiere la disponibilidad de un contador y por esa razón su uso es menos frecuente (Pino Pérez & Jorge Lazo, 2010).
Por las razones antes mencionadas, se propuso el uso del WMicrotracker, un contador óptico de motilidad que consiste en la detección de movimiento mediante microhaces infrarrojos durante 15 minutos y arroja un promedio de estos mediante su software. Los valores obtenidos fueron utilizados para evaluar el efecto del compuesto probado en los tiempos 0, 1 y 24 h.
Cobre
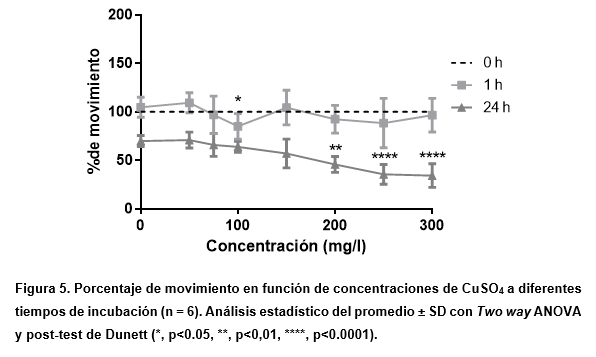
En este caso (Figura 5), se indica que aunque disminuye el movimiento en función del aumento en la concentración de la sal, no se asemeja a lo observado en las pruebas de toxicidad aguda, es decir, no se ve una alteración de la motibilidad acorde a una mortalidad cercana al 100%. Esto puede deberse, por un lado, al mayor número de Artemia requerida en este tipo de ensayo que influye en el acceso al metal y por otro lado, a un análisis que no refleja únicamente la mortalidad, sino también la reducción en la movilidad. De esta manera, se consideran no solo la falta de movimiento debido a la muerte, sino también las reducciones o ausencias de movimiento debido a efectos no letales que afectan los órganos motores. Esta disminución en el movimiento puede deberse a un menor número de artemias con una mayor capacidad de movimiento debido al espacio disponible.
Cabe destacar que el control permite demostrar que las condiciones de la prueba afectarían la salud de las Artemia, ya que se detecta, en promedio, una disminución de hasta el 40% de la movilidad iniciada por la prueba.
Zinc
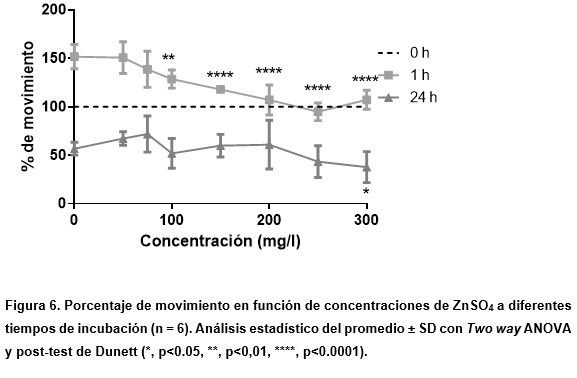
Para este metal en particular, los resultados obtenidos a 24 h fueron contrarios a los esperados (Figura 6), ya que no se observó un efecto decreciente en la movilidad con respecto al aumento de las concentraciones, efecto que se observó a 1 h. La variabilidad a 1 h de incubación respecto de los movimientos registrados deberse a un posible estímulo ante el primer encuentro con la sal y/o en razón del efecto sujeto a la temperatura.
En relación con la primera suposición, la detección de novedad juega un papel muy importante en la adaptación a los cambios ambientales para evitar posibles peligros. Un estímulo novedoso provoca una respuesta que se habituará hasta que se vuelva familiar. Cuando los animales se exponen por primera vez a un ambiente novedoso, lo exploran activamente y lo comparan con experiencias previas almacenadas en su memoria para evaluar su grado de novedad. Sin embargo, cuando se exponen por segunda vez a ese entorno, se puede observar una disminución en la exploración, que se considera como un índice de habituación o familiaridad con el entorno (Moncada & Viola, 2006).
En este segundo caso, se plantea un cambio de temperatura que ocurre en el pasaje de su medio de eclosión a otro contenido en las placas con las soluciones de prueba.
Asimismo, se puede observar una disminución promedio de la viabilidad en el control sin tratamiento a 24 h del 50%. Esto pudo deberse a que las sucesivas diluciones de la suspensión de artemias no hayan tenido el mismo número de individuos y esto afecte la cantidad de metal tomado por cada artemia, modificando el resultado en cada uno de los pocillos. Adicionalmente, las condiciones de la prueba, principalmente el medio salino, no tienen la cantidad de zinc que necesitan para su desarrollo, y por ello, las concentraciones bajas favorecen su desarrollo frente al control. Al respecto, es importante tener encuenta que el zinc es un ion necesario pero tóxico para cada organismo en ciertas concentraciones, tal es el caso de las más altas.
Plomo
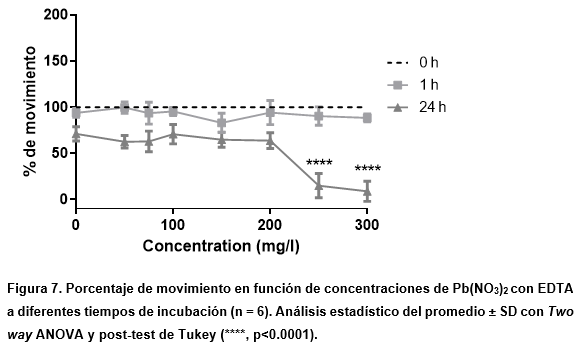
En el caso del Pb(NO3)2 se evaluaron las mismas concentraciones que en la prueba de toxicidad aguda. Estas fueron plomo con EDTA como quelante, como se ve en la Figura 7, y la prueba de control de EDTA mostrada en la Figura 8.
Para las mayores concentraciones de plomo con EDTA, se pudieron observar los efectos esperados, es decir, una disminución en el movimiento con respecto al control a medida que aumentaba la concentración de plomo, como se vio en la prueba de toxicidad aguda.
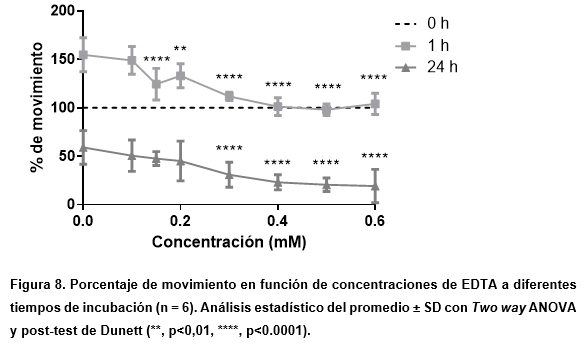
Su efecto sinérgico fue monitoreado y confirmado al observar una marcada disminución en el movimiento a medida que aumentaba la concentración de EDTA, pero sin llegar a la letalidad en sus concentraciones más altas, como sí ocurrió en la prueba de plomo con el quelante.
Cambios morfológicos
Con respecto a las morfologías encontradas, podemos destacar aquellas nombradas y contadas en las tablas 3 y 4, y mostradas en la Figura 9.
Figura 9. Imágenes de microscopía óptica correspondientes a cambios morfológicos desarrollados a las 24 h de incubación en comparación con el control (a): Cambio en la coloración y retardo en el crecimiento (b), disminución en el tamaño de los apéndices (c), ennegrecimiento del intestino (d), inflamación intestinal (e), ennegrecimiento del orificio anal (f), disminución en la masa abdominal (g), deformación de la región abdominal (h).
En relación al control, se puede inferir que la disminución en el tamaño de los apéndices, las modificaciones en la región abdominal y el cambio de coloración o retraso en el crecimiento ocurren debido a las condiciones de la prueba. En la incubación, hay un estado de inanición y falta de aireación, lo que no permite el desarrollo esperado de la etapa de nauplio a metanauplio (al día 1 después de la eclosión).
Otra posible razón por la que se encontraron artemias con una morfología similar a los nauplios recién eclosionados es la posible eclosión de quistes que fueron transferidos a los pozos de prueba, siendo la temperatura de prueba ideal para su correcta eclosión. Los quistes son muy pequeños y, a menudo, es difícil separarlos de las artemias ya eclosionadas. Además, la reducción en la masa abdominal puede deberse a un proceso normal ya que, en etapas posteriores del desarrollo de las artemias, la longitud del abdomen disminuye, reduciendo la masa abdominal; esto acompañada el desarrollo y diferenciación de los apéndices (locomotor, filtrador, prensil y respiratorio) (Sorgeloos et al., 1986).
En cuanto a los cambios relacionados con el tracto gastrointestinal, se puede observar un ligero efecto de ennegrecimiento en el intestino (entre el 10-30% de los animales afectados) en el caso del cobre (a partir de 100 mg/L) y en zinc (a partir de 50 mg/L). Esto podría estar relacionado con el proceso de bioacumulación. En cuanto a la inflamación del intestino en el zinc a partir de 50 mg/L, esto ocurrió en menos del 10% de la población y puede considerarse despreciable (Tabla 3).
Respecto del plomo, se pudo distinguir un efecto asociado al uso de EDTA, ya que probablemente había más plomo soluble y disponible (Tabla 4). En las pruebas con EDTA, se observaron cambios morfológicos similares al control no tratado, por lo que se puede estimar que los cambios observados tanto en la prueba de plomo solubilizado con EDTA serían causados por dicho metal. En cuanto a los resultados obtenidos, se encontró que, al igual que en los casos de cobre y zinc, hubo un efecto de ennegrecimiento del intestino, pero en menos del 10% de la población.
Se encontró que en los tres metales, como se muestra en la figura 10, ocurrió el ennegrecimiento del orificio anal, siendo significativamente mayor (entre el 80-100% de los animales) en el plomo, seguido por el zinc (entre el 30-60%) y finalmente el cobre (entre el 10-30%). Este cambio observado también podría estar relacionado con un efecto de bioacumulación, debido a una disminución en la excreción de los metales divalentes.
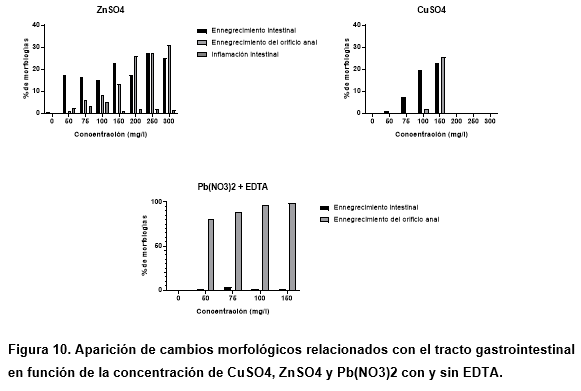
Se ha registrado el proceso de acumulación de metales pesados en aguas contaminadas en artemia adulta, lo que demuestra la gran capacidad de estos microcrustaceos para absorber metales y acumularlos en sus tejidos (Rodríguez Estival, 2018). Sin embargo, se destacó en otros estudios que la acumulación en los nauplios de 1 día es menor en comparación con las otras etapas de la vida de Artemia salina y que ambos son más pequeños en comparación con los nauplios de 7 días (Madhav et al., 2017). Como se puede observar en otros estudios, los procesos de acumulación de metales pesados y sus derivados ocurren en el tracto gastrointestinal durante las diferentes etapas de la vida de la artemia, ya que hay evidencia de ennegrecimiento en diferentes partes del tracto gastrointestinal (Ates et al., 2013; Madhav et al., 2017).
La metodología utilizada permitió discriminar diferentes tipos de efectos toxicológicos utilizando diferentes ensayos (toxicidad aguda y movilidad óptica). Las pruebas fueron rápidas, reproducibles y cuantitativas y permitieron la determinación de la CL50 de dos de los metales sin agregados (cobre y zinc) y de un metal solubilizado por el uso de un quelante (plomo con EDTA) y la determinación de los mecanismos de toxicidad diferenciales en los metales divalentes utilizados. En el caso del cobre, es un efecto a nivel poblacional que afecta a cada organismo según su sensibilidad individual. En el caso del zinc, indicaría una absorción rápida, un efecto rápido o una excreción o desintoxicación lenta. En cuanto al plomo y EDTA, las diferencias encontradas se explicarían por la resistencia individual al compuesto de cada artemia en un corto período de tiempo. Si bien el uso de ambos tiene un efecto sigmoide que muestra que el enfoque correcto para analizar tanto el EDTA como el plomo es la población, es decir, las resistencias individuales de cada crustáceo probado provocan una gran variabilidad.
Con respecto al ensayo de cambios morfológicos, la metodología utilizada permitió reconocer morfologías particulares de cada metal pesado analizado y su relación con el aumento de concentración de cada uno de ellos. Se confirma, además, el efecto de la bioacumulación de metales en el tracto gastrointestinal como se observó en varios trabajos durante las diferentes etapas de la artemia.
Se espera poder continuar analizando otros metales pesados, así como también otros contaminantes conocidos, a modo de plataforma de análisis de muestras de agua de interés.
Ates, M., Daniels, J., Arslan, Z., Farah, I. O., & Rivera, H. F. (2013). Comparative evaluation of impact of Zn and ZnO nanoparticles on brine shrimp (Artemia salina) larvae: effects of particle size and solubility on toxicity. Environmental Science: Processes & Impacts, 15(1), 225–233.
Calienni, M. N., Feas, D. A., Igartúa, D. E., Chiaramoni, N. S., del Valle Alonso, S., & Prieto, M. J. (2017). Nanotoxicological and teratogenic effects: A linkage between dendrimer surface charge and zebrafish developmental stages. Toxicology and Applied Pharmacology, 337, 1–11.
Calienni, M. N., Temprana, C. F., Prieto, M. J., Paolino, D., Fresta, M., Tekinay, A. B., del Valle Alonso, S., & Montanari, J. (2018). Nano-formulation for topical treatment of precancerous lesions: skin penetration, in vitro, and in vivo toxicological evaluation. Drug Delivery and Translational Research, 8(3), 496–514.
Chilcuit, C. F., & Tabashnik, B. E. (1995). Evolution of pesticide resistance and slope of the oncentration-mortality line: are they related? Journal of Economic Entomology, 88(1), 11–20.
Choi, J.Y., Choe, J.R., Koh, J., Choi, C.Y., 2018. Effects of specific light wavelengths on osmotic stress in the ornamental cleaner shrimp Lysmata amboinensis (De Man, 1888) (Decapoda: Caridea: Lysmatidae). J. Crustac Biol. 38, 475–482.
Evenden, A. J., & Depledge, M. H. (1997). Genetic susceptibility in ecosystems: the challenge for ecotoxicology. Environmental Health Perspectives, 105(suppl 4), 849–854.
Fatope, M. O. (1995). Phytocompounds: Their bioassay and diversity. Discovery and Innovation, 7(3), 229–236.
Gambardella, C., Mesarič, T., Milivojević, T., Sepčić, K., Gallus, L., Carbone, S., Ferrando, S., & Faimali, M. (2014). Effects of selected metal oxide nanoparticles on Artemia salina larvae: evaluation of mortality and behavioural and biochemical responses. Environmental Monitoring and Assessment, 186(7), 4249–4259.
Houghton, D. C., Plamp 3rd, C. E., DeFehr, J. M., Bennett, W. M., Porter, G., & Gilbert, D. (1978). Gentamicin and tobramycin nephrotoxicity. A morphologic and functional comparison in the rat. The American Journal of Pathology, 93(1), 137.
Igartúa, D. E., Calienni, M. N., Feas, D. A., Chiaramoni, N. S., Alonso, S. D. V., & Prieto, M. J. (2015). Development of nutraceutical emulsions as risperidone delivery systems: characterization and toxicological studies. Journal of Pharmaceutical Sciences, 104(12), 4142–4152.
Kumar, P., Selvi, S. S., Praba, A. L., Selvaraj, M., Rani, L. M., Suganthi, P., Devi, B. S., & Govindaraju, M. (2012). Antibacterial activity and in-vitro cytotoxicity assay against brine shrimp using silver nanoparticles synthesized from Sargassum ilicifolium. Digest Journal of Nanomaterials and Biostructures, 7(4), 1447–1455.
Madhav, M. R., David, S. E. M., Kumar, R. S. S., Swathy, J. S., Bhuvaneshwari, M., Mukherjee, A., & Chandrasekaran, N. (2017). Toxicity and accumulation of Copper oxide (CuO) nanoparticles in different life stages of Artemia salina. Environmental Toxicology and Pharmacology, 52, 227–238.
Michael, A. S., Thompson, C. G., & Abramovitz, M. (1956). Artemia salina as a test organism for bioassay. Science, 123(3194), 464.
Miguel, T.B.A.R., Porto, E.C.M., de Paiva Pinheiro, S.K. et al. Protective Effect of Natural and Processed Coconut Water by Non-thermal Technologies Against Oxidative Stress in Brine Shrimp (Artemia salina). Food Bioprocess Technol 14, 702–716 (2021).
Møller, V., Forbes, V. E., & Depledge, M. H. (1996). Population responses to acute and chronic cadmium exposure in sexual and asexual estuarine gastropods. Ecotoxicology, 5(5), 313–326.
Moncada, D., & Viola, H. (2006). Phosphorylation state of CREB in the rat hippocampus: a molecular switch between spatial novelty and spatial familiarity? Neurobiology of Learning and Memory, 86(1), 9–18.
Morgana, S., Estévez-Calvar, N., Gambardella, C., Faimali, M., & Garaventa, F. (2018). A short-term swimming speed alteration test with nauplii of Artemia franciscana. Ecotoxicology and environmental safety, 147, 558-564.
Ñañez Pacheco, G. K., Maldonado, N. S. S., Alta, R. Y. P., & Vitorino, H. A. (2021). Short exposure of Artemia salina to group-12 metals: Comparing hatchability, mortality, lipid peroxidation, and swimming speed. Ecotoxicology and Environmental Safety, 213, 112052.
Pillai, K. S. (2023). Classifying chemicals into toxicity categories based on LC50 values-Pros and cons. Journal of Environmental Biology, 44(5), I-III.
Pino Pérez, O., & Jorge Lazo, F. (2010). Ensayo de Artemia: útil herramienta de trabajo para ecotoxicólogos y químicos de productos naturales. Revista de Protección Vegetal, 25(1), 34–43.
Rand, G. M., Wells, P. G., & McCarty, L. S. (2020). Introduction to aquatic toxicology. In Fundamentals of aquatic toxicology (pp. 3–67). CRC Press. Rodríguez Estival, J. (2018). Contaminación en las Marismas del Odiel: una trampa para el zampullín. Divulgazeral. Recuperado a partir de https://www.azeral.es/divulgazeral/ecotoxicologia/contaminacion-en-lasmarismas-del-odiel-una-trampa-para-el-zampullin
Saber, E., El-Tahawy, N. F., Abd El-Raouf, S. A., Ali, A., & Mohammed, S. (2013). Possible protective role of nigella sativa oil on cadmium POSSIBLE PROTECTIVE ROLE OF NIGELLA SATIVA OIL ON CADMIUM INDUCED TOXICITY IN RAT RENAL CORTEX. 24, 111–123.
Sarabia Alvarez, R. (2002). Toxicidad y acumulación de cadmio en poblaciones de diferentes especies de Artemia.
Sarah, Q. S., Anny, F. C., & Misbahuddin, M. (2017). Brine shrimp lethality assay. ||| Bangladesh Journal of Pharmacology|||, 12(2), 186-189.
Schmidt, R. (1985). Optical motility test for the detection of trichothecenes using brine shrimps. Mycotoxin Research, 1(1), 25–29.
Shaw, P. A. G., Panda, S. K., Stanca, A., & Luyten, W. (2022). Optimization of a locomotion-based zebrafish seizure model. Journal of Neuroscience Methods, 375, 109594.
Simonetta, S. H., & Golombek, D. A. (2007). An automated tracking system for Caenorhabditis elegans locomotor behavior and circadian studies application. Journal of Neuroscience Methods, 161(2), 273–280.
Sorgeloos, P. L., Leger, P., Tackaert, P., & W Versichele, D. (1986). Manual para el cultivo y uso de artemia en acuicultura.. FAO.
Tzima, C.S., Banti, C.N. & Hadjikakou, S.K. Assessment of the biological effect of metal ions and their complexes using Allium cepa and Artemia salina assays: a possible environmental implementation of biological inorganic chemistry. J Biol Inorg Chem 27, 611–629 (2022). https://doi.org/10.1007/s00775-022-01963-2Vanhaecke, P., & Persoone, G. (1984). The ARC-test: A standardized short-term routine toxicity test with Artemia nauplii: Methodology and evaluation

