Las lacasas: enzimas versátiles con aplicación en múltiples industrias
Laccases: Versatile enzymes with several industrial applications
Cintia Wanda RiveroJulián Emilio GianoliniLas enzimas son proteínas que actúan como catalizadores naturales y son ubicuas en plantas, animales y microorganismos. Al ser biodegradables, derivadas de recursos renovables y activas en condiciones de reacción suaves, tanto en soluciones acuosas como no acuosas, permiten elevados rendimientos y gran selectividad. Además, debido a que no generan productos secundarios y requieren concentraciones bajas de sustrato, junto con una baja demanda energética, los procesos que catalizan son más eficientes y amigables con el medioambiente que los que se basan en la síntesis orgánica tradicional (Sheldon & van Pelt, 2013).
Durante el siglo XX, la mejora en nuevas técnicas de extracción, purificación y caracterización de enzimas llevó a la producción de muchas de ellas con un elevado nivel de pureza tanto para investigación como para aplicaciones biotecnológicas. Posteriormente, los avances biotecnológicos, en especial la ingeniería genética y de proteínas, revolucionaron la enzimología y la biocatálisis. En el siglo XXI, la biología celular y molecular junto con la bioinformática se convirtieron en disciplinas clave en el desarrollo de biocatalizadores con propiedades óptimas para aplicaciones industriales (Heckmann & Paradisi, 2020). Históricamente, la utilización de enzimas estuvo estrechamente vinculada a una gran variedad de procesos de la industria alimentaria, en especial en la elaboración de queso, cerveza, y vino. Hoy en día, el uso de enzimas se amplió a otras áreas de manufactura de alimentos (panificación, productos lácteos, conversión de almidón, procesamiento de bebidas) y se consolidó para suplantar ciertos procesos químicos, impulsada por el advenimiento de la química verde, en la industria textil, papelera, farmacéutica, cosmética y química (Tabla 1). Asimismo, se han empleado en la elaboración de detergentes, biocombustibles y biosensores, y más recientemente, comenzaron a ser aplicadas con éxito en tratamiento de efluentes y purificación de aguas (Heckmann & Paradisi, 2020; Vogel & May, 2019).
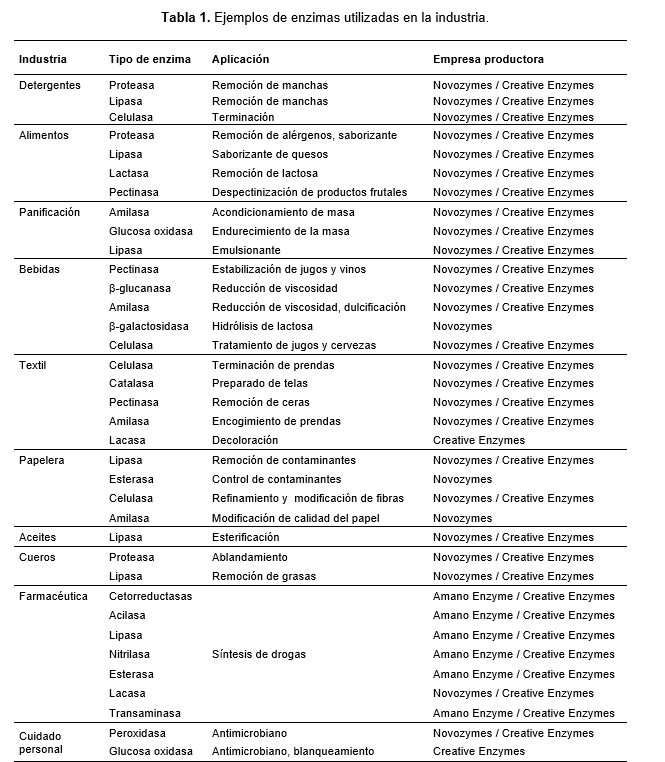
1. 1. La importancia de la inmovilización en biocatálisis
Debido a las múltiples ventajas como catalizadores, el mercado de las enzimas se encuentra en continua expansión, ya en 2005 la producción de enzimas representó 2,6 billones de dólares, de los cuales el 75 % se destinó a uso industrial, y se estimó para las décadas siguientes un crecimiento anual mayor al 9 % (Elnashar, 2010). Para el 2021, el monto alcanzó los 8,9 billones de dólares y se espera alcanzar los 13,2 billones de dólares para fines del 2025, con una tasa anual de crecimiento compuesto (CAGR) de 14 % (Maghraby et al., 2023). Se estima que el 56 % de las enzimas recombinantes comercialmente disponibles son bacterianas, producidas mayoritariamente por Escherichia coli (24 %) seguido por los géneros Streptomyces y Bacillus, siendo este último el huésped preferido por pertenecer al grupo de organismos GRASS (generalmente reconocidos como seguros) y por ser productor de proteínas de origen Gram-positivo (Vojnovic et al., 2024).
No obstante, la aplicación industrial de estas enzimas está limitada por los altos costos asociados a su aislamiento y purificación, su incapacidad de ser reutilizadas y la pérdida de estabilidad bajo condiciones de reacción exigentes. Para superar estas restricciones, se han desarrollado diversas estrategias destinadas a optimizar su uso en procesos biotecnológicos, con el propósito principal de reducir los costos de producción e implementación. Entre estas estrategias, se han destacado los métodos de inmovilización (Maghraby et al., 2023; Lapponi et al., 2022).
Las enzimas inmovilizadas pueden separarse fácilmente de la fase líquida, lo que minimiza o evita la contaminación del producto (un aspecto crítico en la industria farmacéutica y alimentaria), pueden recuperarse y reutilizarse, lo que además, da lugar a una rápida detención de la reacción (Lapponi et al., 2022; Sheldon & van Pelt, 2013). Por lo tanto, la inmovilización no solo permite la recuperación y reutilización de las enzimas, sino que también ayuda a mantener su estructura frente a diferentes condiciones, lo que puede preservar su actividad e incrementar su estabilidad. Con el procedimiento adecuado, las enzimas muestran mayor resistencia a temperaturas elevadas, variaciones de pH, solventes e inhibidores. Esto las vuelve particularmente atractivas para ser aplicadas en diversos campos de la industria al incrementar significativamente la productividad del proceso y amortizar los costos iniciales de producción (Lapponi et al., 2022; Sajeevan et al., 2024). Sin embargo, el proceso de inmovilización puede acarrear desventajas al exhibir problemas de transferencia de masa, cambios conformacionales y desnaturalización, y modificaciones en las propiedades de la enzima que devengan en su desactivación total (Guzik et al., 2014). Además del tipo de inmovilización, es importante considerar la matriz o soporte empleado. Así pues, este debería poseer una estabilidad adecuada, una estructura porosa y una superficie elevada que maximice la eficiencia de inmovilización (Maghraby et al., 2023).
La mayoría de los métodos de inmovilización explotan las características de los aminoácidos de las proteínas mediante la formación de diferentes tipos de uniones e interacciones de los grupos funcionales pertenecientes a los residuos de las cadenas laterales (Mohamad et al., 2015). Las enzimas pueden ser inmovilizadas por varias metodologías diferentes que se dividen en, principalmente, métodos físicos y químicos (Figura 1). En los primeros, existen interacciones débiles entre el soporte y la enzima, entre ellas puentes de hidrógeno, interacciones hidrofóbicas, fuerzas de Van der Waals, uniones por afinidad, enlaces iónicos y contención mecánica; y el soporte puede ser una resina sintética, un biopolímero o un polímero inorgánico (Trelles & Rivero, 2020, Lapponi et al., 2022). En los métodos químicos, se producen uniones covalentes de diferente tipo (enzima-soporte o enzima-enzima), para formar agregados sólidos activos (Sajeevan et al., 2024). A su vez, es relevante mencionar la posibilidad de combinar distintos tipos de interacción del soporte o matriz con una o más proteínas, con el objetivo de obtener un biocatalizador que responda a cada necesidad.
2.1- Distribución
La primera lacasa fue identificada por Yoshida en 1883 en exudados de árboles de laca japoneses (Rhus vernicifera). De hecho, el nombre de esta enzima se debe a la capacidad de oxidar alquilcatecoles como el urushiol y el lacol, normalmente presentes en la savia de ese árbol (Du et al., 1984). Posteriormente, se reportaron lacasas en una amplia variedad de vegetales: arroz, algodón, mango, durazno, maíz, tabaco, pino y césped (Dijkstra & Walker, 1991; Morozova et al., 2007). Estas enzimas se encuentran ampliamente distribuidas en la naturaleza y están involucradas en procesos de síntesis y de degradación. En plantas, su función está relacionada con el proceso de lignificación, en el mecanismo de sanado de heridas y respuesta a patógenos, además de estar involucradas en el metabolismo del hierro (Hoopes & Dean, 2004).
Las lacasas fúngicas, principalmente de Ascomycetes, Deuteromycetes y Basidiomicetes, han sido tradicionalmente elegidas por su elevado potencial redox – generalmente superiores a 700 mV – y porque se secretan al medio, lo que facilita su detección y recuperación. Estas enzimas extracelulares participan en procesos fisiológicos diversos, como morfogénesis, detoxificación, interacción hongo‑planta, defensa frente a estrés y degradación de lignina. En contraste, las lacasas bacterianas fueron identificadas más tardíamente: la primera descrita fue la de Azospirillum lipoferum en 1993 (Givaudan et al., 1993), y en 2003 se cristalizó una de Bacillus subtilis (Enguita et al., 2003). En bacterias, las lacasas desempeñan funciones en morfogénesis, síntesis de pigmentos en esporas, protección frente a radiación UV y homeostasis de metales como hierro y cobre (Giardina et al., 2010; Akram et al., 2022).
2.2- Descripción general
La familia multicobre está caracterizada por enzimas que contienen átomos de cobre en el centro catalítico, e integra los grupos de ascorbato oxidasas, ceruloplasminas, manganeso oxidasas y polifenol oxidasas, entre otros. Las lacasas (bencendiol: oxígeno óxidoreductasas, EC 1.10.3.2) forman parte de las polifenol oxidasas (Enguita et al., 2003). A diferencia de muchas enzimas que catalizan reacciones sustrato-específicas, las lacasas no necesitan la adición de peróxidos o cofactores como NAD(P)H para oxidar el sustrato, utilizan únicamente oxígeno molecular como co-sustrato y generan agua como producto secundario (Akram et al., 2022; Santhanam et al., 2011). Estas enzimas catalizan la oxidación de una amplia variedad de moléculas, como fenoles, polifenoles, fenoles sustituídos, diaminas, hidroxiindoles, aminas aromáticas y bencentioles, y también son capaces de oxidar compuestos xenobióticos como metoxifenoles y anilinas (Piscitelli et al., 2010). Además, tienen la capacidad de oxidar compuestos inorgánicos como triyoduro de potasio, [Fe (CN)6]-4, [Os(CN)6]-4 y [W(CN)8]-4 (Morozova et al., 2007). Esta variabilidad de sustratos deja en evidencia la baja especificidad de la enzima y su potencial en la industria biotecnológica en diversos campos, que incluye el tratamiento y detoxificación de efluentes, la bio-nanotecnología, la química fina y el tratamiento de textiles y papel (Niladevi & Prema, 2008; Pawlik et al., 2016).
2.3- Lacasas bacterianas frente a las fúngicas
Entre las lacasas, aquellas provenientes de hongos han sido tradicionalmente elegidas no solo por su mayor potencial redox sino también por ser extracelulares, lo que en un principio facilitó su detección y recuperación. En contraparte, la mayoría de las lacasas bacterianas identificadas al momento son de origen intracelular, entre las cuales destacan Marinomonas mediterránea, Sinorhizobium meliloti y Bacillus subtilis.
Sobre su estabilidad, las lacasas de origen fúngico operan solo en un rango de 30 a 50 °C y en condiciones levemente ácidas, y son susceptibles a condiciones inhibitorias que suelen encontrarse en procesos escalados de industrias (Kudanga, 2024). En contraste, las lacasas bacterianas exhiben mayor actividad y estabilidad a temperaturas elevadas, mayor rango operacional de pH (incluido condiciones básicas) y pueden tolerar altas concentraciones salinas e iones metálicos (Akram et al., 2022).
Los hongos suelen producir varias isoenzimas con diferentes propiedades, con pesos moleculares variables (entre 60 y 110 kDa) y estructuradas como dímeros o trímeros. Además, poseen diferentes grados de glicosilación, que representan hasta un 45 % de su peso molecular (Pawlik et al., 2016). Estas características dificultan notablemente su expresión heteróloga (Kudanga, 2024). Por otro lado, no se han reportado, al momento, bacterias que generen isoenzimas de lacasas. En bacterias, las lacasas suelen organizarse ya sea como monómeros, trímeros o tetrámeros no glicosilados con pesos moleculares que varían entre 28 y 180 kDa (Santhanam et al., 2011).
Si bien los hongos son capaces de producir títulos elevados de lacasa extracelular, los sistemas de producción poseen varias desventajas. Los fermentadores de estado sólido (sistemas de bandejas, tambores rotatorios o lecho empacado) requieren elevado mantenimiento y superficie de terreno libre, lo que limita su aplicación en escala. Además, las configuraciones agitadas pueden dañar la biomasa y reducir la viabilidad (Niladevi & Prema, 2008; Pannu & Kapoor, 2014). Por último, las cinéticas de producción de las lacasas fúngicas son considerablemente más lentas que las bacterianas y generan una elevada cantidad de biomasa (Kudanga, 2024).
La demanda de lacasas en el sector industrial requiere de sistemas eficientes de producción de las mismas, por lo que resulta de especial interés la búsqueda de otros tipos de productores. Por un lado, la viabilidad de la producción heteróloga de lacasas fúngicas se ve comprometida por la dificultad de obtener formas activas, no solo por la repetitividad de los patrones y niveles de glicosilación sino también por el uso de codones y la presencia de intrones. Por otra parte, la producción de lacasas de origen bacteriano en biorreactores tiene un importante potencial en la industria biotecnológica, ya que existen múltiples herramientas para la ingeniería de proteínas, clonado y sobre-expresión, lo cual puede compensar los conflictos que genera una enzima intracelular en procesos downstream. Asimismo, los parámetros de fermentación de cultivos bacterianos para la producción en escala industrial de enzimas se controlan fácilmente (Kudanga, 2024; Luo et al., 2018).
2.4- Sitio catalítico
Análisis filogenéticos demostraron que los dominios de unión a cobre de las lacasas son altamente conservados, incluso aunque el resto de la proteína tenga un porcentaje elevado de variabilidad (Valderrama et al., 2003). Inicialmente, alineamientos entre genes de plantas y hongos mostraron una firma única que caracteriza a las lacasas como un subgrupo de enzimas multicobre. Esta firma comprende cuatro segmentos que oscilan entre 8 y 24 residuos dispersos en la secuencia de la proteína, que codifican 12 aminoácidos esenciales ligandos de este metal en los que están involucradas secuencias con histidinas (Kumar et al., 2003). Posteriormente, estudios de secuencias bacterianas describieron los mismos motivos conservados de unión a cobre (Pawlik et al., 2016; Gupta et al., 2019; Basheer et al., 2017). Hoy en día, la secuencia consenso que involucra al cuarto segmento o dominio, H-C-H-x(3)-H-x(3)-[AG]-[LM] recuperada desde la plataforma PROSITE (Sigrist et al., 2013), es ampliamente utilizada para la detección de esta enzima por métodos bioinformáticos (Kumar et al., 2018).
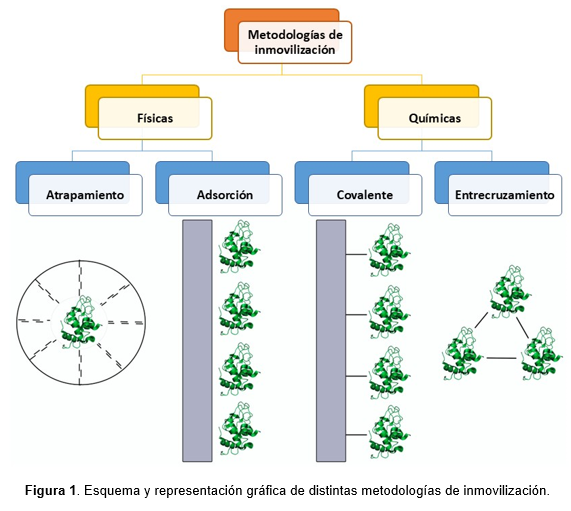
Las lacasas utilizan como único cofactor cuatro átomos de cobre por monómero, distribuidos en tres sitios redox denominados T1, T2 y T3, clasificados de acuerdo a sus propiedades espectroscópicas y paramagnéticas (Davies & Ducros, 2002; Leontievsky et al., 1997). El tipo I (T1) es un clúster mononuclear que aporta un característico color verde-azulado a las lacasas, producto de la interacción del cobre oxidado con una cisteína, y posee un máximo de absorción en 610 nm. Este es el sitio más expuesto al solvente, donde se une y oxida el sustrato. Su átomo de cobre puede ser removido tanto por agentes complejantes como quelantes, e incluso sustituido por otros metales, lo que puede afectar de forma considerable la actividad enzimática. Existen lacasas que de forma natural no tienen cobre sino hierro, zinc o manganeso en este sitio y no poseen color azul, por lo que se las denomina “Yellow / White laccases” (Kudanga, 2024; Santhanam et al., 2011).
Por su parte, el tipo II (T2) consiste en un sitio mononuclear rodeado de una estructura tetragonal y posee absorción insignificante en el rango UV-Vis, pero es detectable por espectroscopía de resonancia paramagnética de electrones (EPR). Por otro lado, el tipo III (T3) forma un sitio binuclear compuesto por dos átomos de cobre unidos por un grupo hidroxilo, que en conjunto anulan sus propiedades ferromagnéticas y, consecuentemente, no aportan señal en EPR pero sí a 330 nm en su estado oxidado. Los sitios T2 y T3 forman un clúster trinuclear capaz de reducir una molécula de oxígeno y liberar agua como producto. Esta transferencia sucede en un único evento, ya que no se detectó liberación de peróxido de hidrógeno intermediario y, debido al tamaño del bolsillo de entrada al sitio T2, se estima que solo ingresa oxígeno molecular como co-sustrato (Gianfreda et al., 1999).
A través de análisis por cristalografías, se determinó que el sitio T1 de las lacasas fúngicas y bacterianas está coordinado por dos histidinas, una cisteína y usualmente una metionina o leucina y que, además, está conectado al clúster trinuclear T2/T3 a través de canales de agua formados por residuos polares (Enguita et al., 2003; Hakulinen et al., 2002). Por otra parte, el sitio T2/T3 forma un triángulo casi equilátero de 4 Å de lado (Garavaglia et al., 2004), en el cual los dos átomos de cobre T3 están coordinados simétricamente con tres átomos de nitrógeno de las His que los rodean y forman un puente de oxhidrilo (Shraddha et al., 2011). El cobre T2, mientras tanto, está coordinado por dos histidinas y posee un sitio libre capaz de asociarse a un oxhidrilo o agua. La figura 2 ilustra la disposición de los átomos del sitio activo de la lacasa CotA de Bacillus subtilis.
A pesar del elevado consenso en las secuencias del sitio de unión a cobre y los parámetros electro y paramagnéticos, el potencial redox (E0) de las lacasas varía ampliamente (entre 400 y 790 mV) (Akram et al., 2022), dependiendo de la identidad de los aminoácidos que rodean el sitio activo, especialmente en el sitio T1. Al ocurrir en este último la unión y oxidación del sustrato, su potencial establece cuán eficiente puede ser la catálisis y determina el tipo de molécula que puede aceptar como donor (Xu et al., 1999). Sin embargo, si bien el potencial de oxidación del sustrato depende mayoritariamente de la diferencia redox entre el sustrato y el sitio T1, otros factores como el tamaño, forma y complejidad del sustrato también afectan la oxidación (Kudanga, 2024). A modo de ejemplo, se determinó que la incorporación de un aminoácido no polar (como fenilalanina o leucina) en vez de metionina en la posición axial al sitio T1 incrementa significativamente el potencial de la lacasa (Kumar et al., 2003). Si bien las lacasas fúngicas poseen mayor potencial redox que las bacterianas (E0 alrededor de 800 mV vs. 500 mV), se ha demostrado que mediante mutagénesis dirigida no solo se puede incrementar el potencial de estas últimas (Prins et al., 2015; Shao et al., 2009), sino otras características como su solubilidad (Luo et al., 2018), y estabilidad a pH alcalino y a temperaturas elevadas (T. Li et al., 2021).
2.5- Mediadores redox
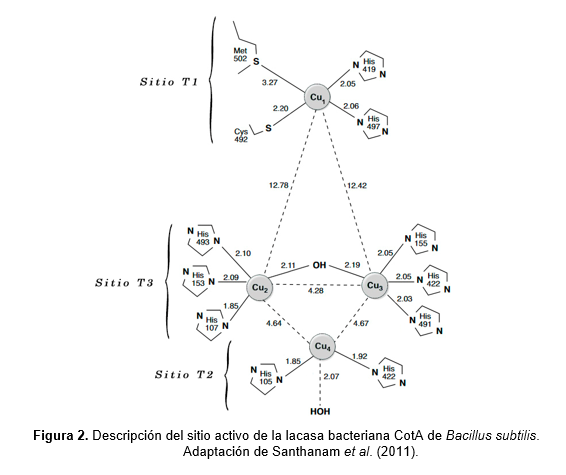
Indistintamente de su origen, la actividad catalítica de las lacasas no se restringe a un único sustrato, ya que actúan sobre un amplio rango de moléculas fenólicas y no fenólicas. Por este motivo, las lacasas pueden utilizarse en distintos procesos biotecnológicos tanto en escala de laboratorio como industrial. El uso de moléculas mediadoras para estas enzimas fue originalmente desarrollado para solucionar problemas de rendimiento en bioblanqueamiento de pulpa de madera, descrito por primera vez en 1990 (Bourbonnais & Paice, 1990). En la actualidad existen más de 100 compuestos mediadores, aunque los más utilizados son el ácido 2,2´-azino-bis-(3-etilbenzotiazolina)-6-sulfónico (ABTS), 1-hidroxibenzotriazol (HBT), N-hidroxi-acetanilida (NHA), ácido violúrico (VLA), N-hidroxibiftalimida (HPT) y 2,2,6,6-tetrametilpiperidina-N-oxil (TEMPO) (Pannu & Kapoor, 2014). A partir del siglo XXI, la búsqueda de nuevos mediadores se orientó hacia compuestos naturales y derivados como el siringaldehído, acetosiringona, vainillina y ácido p-cumárico, debido al elevado costo de los de origen sintético (Camarero et al., 2005).
Los mediadores son fácilmente oxidados por la lacasa en el sitio T1, y forman intermediarios catiónicos inestables con elevado potencial redox, capaces de oxidar moléculas más complejas por mecanismos no enzimáticos (Majcherczyk & Johannes, 2000). El uso de mediadores, por lo tanto, permite la oxidación de moléculas poliméricas al resolver problemas de impedimento estérico, y además incrementa el rango de sustratos de la enzima al posibilitar la toma de electrones de moléculas con un potencial redox mayor que el de la propia lacasa (Fabbrini et al., 2002). No obstante, a pesar de los beneficios que aportan, pueden generar subproductos de reacción y pueden inactivar la enzima en concentraciones mayores a 1 mM (Kunamneni et al., 2007; Riva, 2006). La figura 3 es una representación esquemática del ciclo catalítico del sistema lacasa-mediador.
2.6- Mecanismo de reacción
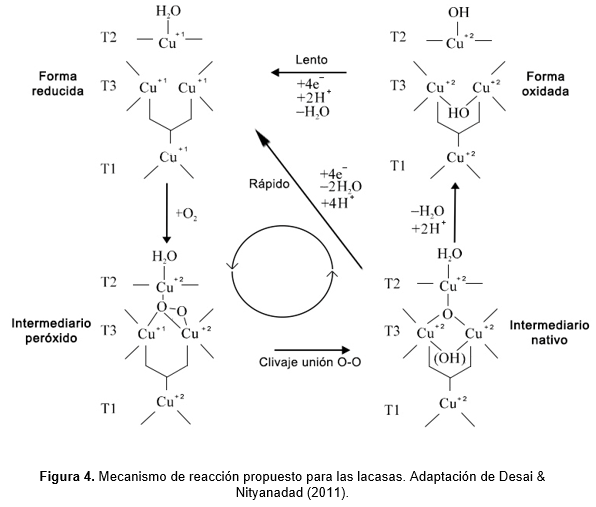
Uno de los primeros autores en proponer el mecanismo de oxidación de un sustrato catalizado por la lacasa, con la reducción de una molécula de oxígeno y formación de agua, fue Torres et al. (2003). Posteriormente, esta propuesta fue completada por otras investigaciones.
1- Tras unirse al sitio T1, el sustrato (S) es oxidado mediante la transferencia de un electrón al centro Cu+2, el cual se reduce a Cu+1. Esta abstracción electrónica genera un radical libre catiónico inestable a partir de la molécula del sustrato. La evolución posterior de este radical es diversa: puede experimentar una oxidación enzimática adicional mediada por la lacasa o por oxidasas alternativas, o puede participar en transformaciones no enzimáticas al hidratarse, desprotonarse o polimerizarse (Guzik et al., 2014).
2- La lacasa actúa como una batería, ya que se precisan cuatro electrones para reducir el oxígeno y se obtiene uno a la vez durante la oxidación, por lo que se requieren cuatro oxidaciones consecutivas de sustrato. Estos electrones se acumulan en los átomos de cobre del sitio activo.
3- Cada electrón extraído de las cuatro oxidaciones es transferido, a través de los residuos de cisteína e histidina, desde el sitio T1 al clúster trinuclear T2/T3, donde se encuentra unida una molécula de oxígeno. Luego, el oxígeno se reduce y se forman dos moléculas de agua que se liberan del sitio catalítico.
La reacción global es la siguiente:
4 SH + O2 → 4 S +2 H2O
Luego, se detalló la forma de interacción del oxígeno molecular con el sitio activo de la lacasa (Singh et al., 2011). Primero, el oxígeno, que se encuentra interactuando con el clúster T2/T3 completamente reducido, recibe dos electrones desde el sitio T1 y forma un intermediario peróxido que contiene el anión dioxígeno. Mientras uno de los átomos de oxígeno permanece unido a los iones de cobre T2 y T3, el otro lo hace sólo con el cobre T3. Luego, el intermediario peróxido recibe otros dos electrones, momento en el que se cliva la unión O-O, se libera agua y se genera un intermediario nativo completamente oxidado, donde un oxígeno (como oxhidrilo) interactúa con los átomos de cobre del sitio T3 y otro lo hace con el cobre T2 (Desai & Nityanand, 2011). La figura 4 ilustra el mecanismo de reacción propuesto para las lacasas.
2.7- Aplicaciones de lacasas en la industria
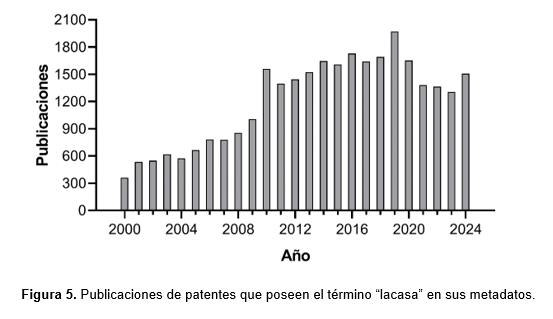
De acuerdo a la plataforma LENS (https://www.lens.org/), desde el 2000 hasta la actualidad se registran 30517 eventos de patentes que involucran lacasas, con una tendencia creciente hasta el 2019 (Figura 5). A partir de ese momento, el recuento total disminuyó. No obstante, dicho comportamiento también se observa con proteasas, lipasas y amilasas, por lo que podría representar un efecto post-pandemia. De hecho, la demanda global de enzimas cayó drásticamente debido a perturbaciones en las cadenas de suministro (Maghraby et al., 2023). De acuerdo a Zerva y colaboradores (2019), la mitad de las patentes de lacasas registradas en el período 2008-2018 corresponde al sector industrial, y aún existe una brecha entre las publicaciones científicas y la cantidad de patentes, lo cual sugiere un interés elevado en I+D que puede traducirse en un aumento de patentamientos en los próximos años.
Existen numerosos sectores en proceso de investigación sobre metodologías enzimáticas para el desarrollo de nuevas tecnologías vinculadas a la química verde, particularmente debido a las desventajas asociadas a los procesos físico-químicos tradicionales, el aumento de la conciencia ambiental y las restricciones regulatorias. Asimismo, las lacasas son capaces de oxidar una amplia variedad de compuestos fenólicos y no fenólicos, sintéticos y naturales, desde subunidades lignocelulósicas hasta compuestos elevadamente recalcitrantes. En este contexto, estas enzimas son usadas en forma libre e inmovilizada en una amplia variedad de aplicaciones biotecnológicas, que incluyen las industrias papelera, textil, cosmética, farmacéutica y alimenticia, biorremediación de suelos y aguas, degradación de disruptores endócrinos y microplásticos, química sintética, biosensores y aplicaciones analíticas (Deska et al., 2019; Othman et al., 2022) (Figura 6). En particular, las enzimas inmovilizadas han adquirido una creciente relevancia comercial debido a sus ventajas operativas, como la reutilización del biocatalizador, la mejora de la estabilidad y la posibilidad de integración en procesos continuos, lo que las convierte en herramientas clave para una biocatálisis más eficiente y económicamente viable. Como reflejo de esta tendencia, numerosas empresas líderes en biotecnología, como Novozymes, Amano Enzyme Inc. y DuPont, ya ofrecen enzimas comercializadas directamente en forma inmovilizada, evidenciando su consolidación en el mercado global.
2.7.1- Industria textil
El primer producto comercial con lacasas aplicado en la industria textil fue DeniLite®, lanzado por Novozymes en 1996, una propuesta sustentable para reemplazar agentes blanqueadores como el hipoclorito de sodio y peróxido de hidrógeno. A partir de ese momento, aparecieron productos similares con el objetivo principal de oxidar el Índigo Carmín presente en las telas y los efluentes que poseían este colorante (Zerva et al., 2019). En los últimos años, las investigaciones se centraron también en procesos de tinción de lana y nylon a través de polimerización de compuestos fenólicos (Prajapati et al., 2018). Además de lo ya mencionado, se pueden usar en la eliminación de olores generados en el proceso de lavado y en la sustitución del cloro en el tratamiento de anti-encogimiento (Ciullini et al., 2008; Kunamneni et al., 2007). En todos los casos, el objetivo es disminuir el uso del agua, energía y productos químicos. En cuanto a patentes asociadas, encontramos pretratamientos de algodón en condiciones suaves (CN109722908A, CN108642854A), uso de lacasas para la síntesis de precursores de colorantes (CN108978270A, CN103952927A) y tratamiento antibacterial (CN108893982A, CN105951436A), entre otras.
2.7.2- Industria papelera
La primera etapa de la elaboración del papel consiste en convertir a la materia prima fibrosa, proveniente de la madera, en pulpa mediante la remoción del material no celulósico (en especial la lignina, un polímero polifenólico irregular). Tradicionalmente, esto se realiza mediante abrasión mecánica, a través de un proceso ácido (sales de sulfito) o alcalino (Kraft). Mientras que el primero requiere elevadas cantidades de energía eléctrica y da como resultado un papel que se torna amarillo con el tiempo, el segundo utiliza grandes cantidades de agua con menos rendimiento de pulpa y origina fibras más resistentes (Zerva et al., 2019). En este contexto, las lacasas portan un rol promisorio e importante en la búsqueda de minimizar el uso del agua y disminuir el impacto ambiental de los procesos (Kunamneni et al., 2007; Singh & Arya, 2019). Pueden ser utilizadas en numerosos pasos de la industria textil al reemplazar procesos de oxidación, desde la deslignificación y elaboración de la pulpa y posterior blanqueamiento, hasta la degradación de las tintas presentes en el papel reciclado, modificación enzimática del papel, tratamiento de los efluentes e incluso revaloración de la lignina en productos comerciales como vainillina o siringaldehído. Por estas razones, la mayor cantidad de patentes registradas desde el 2010 que involucran a esta enzima corresponden a la categoría de remoción y modificación de lignina, bajo el concepto de biorrefinerías integradas (Mate & Alcalde, 2017; Zerva et al., 2019). Entre ellas, destacan el uso de mediadores y lacasas modificadas para la mejora de procesos (CN109098025A, CN108823177A), mejoras del papel a través de menor pérdida de pulpa, blanqueamiento y reusabilidad (CN105133409A, CN105178084A) y tratamiento de efluentes clorados (CN106045004A).
2.7.3- Industria alimentaria
Existen numerosas aplicaciones de lacasas en alimentos. Entre ellas, destacan aquellas aplicadas a la producción de bebidas, donde mejoran la calidad del producto al reemplazar el uso de carbón activado en la remoción de fenoles (Mayolo-Deloisa et al., 2020). Para ello, se generan complejos fenólicos a través de la oxidación enzimática, que luego son retirados de la bebida mediante el uso de membranas (Zerva et al., 2019). La estabilización de vinos es una de las principales aplicaciones, ya que se mejora el sabor al remover derivados de lignina generados durante el proceso de maderización. Asimismo, en el tratamiento de cervezas, jugos de uva y manzana, puede ser empleada para solucionar la aparición de turbidez debido a la formación de polímeros fenólicos (WO2014009849A2, Kafeel et al., 2021). En la industria panificadora, el uso de lacasas como aditivos puede mejorar las características del pan al fortalecer las estructuras de la masa y mejorar su aceptabilidad (sabor, estabilidad, frescura, suavidad, textura), incluso si se utilizan harinas de baja calidad, lo cual abarata costos (Kafeel et al., 2021; Minussi et al., 2002; WO2019201725A1). Por otra parte, las lacasas se usan en gelificación de pectina de remolacha (Lin 2023), y oxidación de fenoles presentes en efluentes de la industria alimenticia (CN102718368A, Ejembi et al., 2022; Madhavi & Lele, 2009).
2.7.4- Industria cosmética y farmacéutica
Debido a su habilidad para oxidar una amplia variedad de compuestos orgánicos, las lacasas se encuentran en un campo emergente en la síntesis de antibióticos, drogas anticancerígenas, anestésicos, antiinflamatorios y sedantes, a través de la catálisis de acoplamiento oxidativo (Mate & Alcalde, 2017; Zerva et al., 2019). Además, se ha demostrado que una lacasa bacteriana, por sí misma, posee efectos antifúngicos y antibacterianos (Verma et al., 2018). En la industria cosmética, la enzima puede reemplazar al peróxido de hidrógeno en la oxidación de melanina y puede usarse también para la tinción del cabello (Panwar et al., 2022; Shin et al., 2019). Existen patentes para un método de síntesis de un substituto de ácido hialurónico (CN104745662A), y se utilizan en desodorantes para uso personal y vertidos industriales (EP1569611A1), y en jabones y detergentes (WO2020002187A1). En particular, la industria dedicada a detergentes representa una fracción importante dentro del mercado de enzimas. Si bien las más utilizadas involucran proteasas, amilasas, celulasas y lipasas, el uso de lacasas es cada vez más frecuente (CN104263544A, US20180127687A1, CN112088209A, DK202330021A1).
2.7.5- Biorremediación
Las lacasas son capaces de oxidar hidrocarburos policíclicos aromáticos (PAHs) derivados del uso y almacenamiento de combustibles fósiles, así como también bifenilos policlorados (PCBs). Estas dos grandes familias se encuentran entre los compuestos xenobióticos más peligrosos y pueden estar distribuidos en ambientes terrestres y acuáticos (US20240002829A1) (Šrédlová et al., 2021). Un sistema lacasa-mediador puede oxidar tanto PAHs de bajo peso molecular como los más recalcitrantes a quinonas, lo que reduce su peligrosidad debido a que estas son menos mutagénicas y carcinogénicas que sus predecesoras (Torres et al., 2003). Entre PAHs degradados, encontramos benzopireno, naftaleno y antraceno (Deng et al., 2022). Además, se pueden tratar fenoles y derivados (S. Li et al., 2022; Xia et al., 2021), pesticidas (Jin et al., 2016; Srinivasan et al., 2020), colorantes (Britos et al., 2016; Britos et al., 2018; Gianolini et al., 2020; Muthu & Khadir, 2021), poliuretanos (Y. Zhang et al., 2023), y contaminantes emergentes como pueden ser antibióticos, analgésicos, parabenos, hormonas, y derivados plásticos como bisfenoles y biftalatos (Barrios-Estrada et al., 2018).
2.7.6- Otras aplicaciones
Se estudió el uso de lacasas como biosensores para la detección de compuestos fenólicos, aminas aromáticas, dopamina, insulina, epinefrina, tartrazina, residuos farmacéuticos y oxígeno (Campaña et al., 2019; Kadam et al., 2022). Además, se han empleado como catalizadores en celdas de biocombustibles (Betancor et al., 2013, Ottoni et al., 2023), en el reemplazo del formaldehído para el entrecruzamiento de materiales lignocelulósicos para la producción de fibrofácil (Mate & Alcalde, 2017) y su tinción (Colella et al., 2021). También pueden aplicarse en la síntesis orgánica de compuestos bioactivos (Cardullo et al., 2022), así como en la síntesis de acrilamida (Mita et al., 2003). Además, se utilizan en la producción de bioetanol por eliminar compuestos fenólicos inhibidores de las levaduras fermentadoras (Ibarra et al., 2023), y en la degradación de la lignina en compuestos fermentables (Avanthi & Banerjee, 2016).
Actualmente, la optimización del sitio de unión a ribosoma (RBS), de los péptidos señal unidos a la proteína, del promotor para la transcripción y la edición del genoma del huésped son estrategias clave implementadas para incrementar la producción de enzimas bacterianas. Entre ellas, la tecnología CRISPR-Cas9 ha permitido realizar modificaciones genómicas precisas para aumentar la expresión de proteínas de interés y, al mismo tiempo, insertar genes heterólogos directamente en el genoma del huésped, evitando el uso de plásmidos y reduciendo significativamente los riesgos asociados a la transferencia horizontal de genes (Vojnovic et al., 2024). Estas herramientas han mejorado notablemente la eficiencia del diseño de sistemas de expresión, aunque su aplicación a nivel industrial requiere una cuidadosa selección del huésped, optimización de las condiciones de cultivo y escalabilidad del proceso. Aun así, uno de los principales cuellos de botella sigue siendo el elevado costo asociado a la producción de enzimas recombinantes, que incluye gastos en medios de cultivo, purificación, control de calidad y validación funcional. A esto se suman los requisitos regulatorios estrictos para estas enzimas, especialmente en sectores como el alimentario o farmacéutico, donde se exige demostrar la ausencia de endotoxinas, elementos móviles y contaminantes, además de garantizar trazabilidad completa. Estas exigencias pueden aumentar significativamente el tiempo y los costos de aprobación, lo que representa una clara desventaja frente a alternativas químicas o enzimas fúngicas, que suelen tener una trayectoria más consolidada (Jayakrishnan et al., 2024).
En paralelo, la evolución dirigida se ha afianzado como una estrategia fundamental para generar biocatalizadores específicos y eficientes. Este enfoque, en constante desarrollo, ha incorporado recientemente innovaciones en el diseño de bibliotecas genéticas, en los métodos de cribado de alto y ultra-alto rendimiento, así como en plataformas de evolución continua in vivo (Aza & Camarero, 2023). Sin embargo, el desarrollo de una enzima completamente optimizada para procesos industriales sigue requiriendo equipos altamente especializados, tecnologías estandarizadas y una coordinación efectiva de todas las etapas del proceso, desde la ingeniería genética hasta la validación funcional a gran escala. La integración de herramientas bioinformáticas y el aprendizaje automático promete acelerar la ingeniería enzimática, aunque su aplicación práctica aún se ve limitada por la necesidad de grandes volúmenes de datos experimentales y por la complejidad del procesamiento de estos datos. Además, se reconoce cada vez más que la dinámica estructural de las enzimas – más allá del modelo clásico de llave y cerradura – desempeña un papel crucial en su función catalítica, ofreciendo nuevas perspectivas para el diseño racional de lacasas bacterianas con propiedades mejoradas (Heckmann & Paradisi, 2020).
En este contexto, la producción de lacasas bacterianas recombinantes representa una frontera biotecnológica en expansión, impulsada por la convergencia entre la ingeniería genética, el modelado computacional, la evolución dirigida y la mutagénesis específica. A pesar de su notable versatilidad catalítica, mayor velocidad de producción y adaptabilidad a la expresión heteróloga, las lacasas bacterianas aún se enfrentan a ciertas limitaciones que explican su escasa presencia en el mercado. Entre ellas, se destacan la baja disponibilidad de variantes bien caracterizadas y la falta de antecedentes regulatorios robustos (Akram et al., 2022; Kudanga, 2024). En contraste, las lacasas fúngicas han sido extensamente utilizadas, se secretan de forma natural al medio, y cuentan con protocolos estandarizados y marcos normativos ya establecidos, lo que ha favorecido su adopción industrial (Aza & Camarero, 2023; Mayolo-Deloisa et al., 2020). A ello se suma que varias de estas enzimas fúngicas ya han sido exitosamente adaptadas a sistemas recombinantes, lo que reduce la brecha tecnológica entre ambas alternativas. En este escenario, las lacasas bacterianas solo podrán posicionarse como una alternativa real si logran ofrecer ventajas funcionales diferenciales, como mayor estabilidad estructural, resistencia a condiciones extremas o capacidad de oxidar sustratos recalcitrantes. A medida que se superen las barreras técnicas y regulatorias, los avances en ingeniería genética y expresión heteróloga permitirán el desarrollo de biocatalizadores optimizados para aplicaciones industriales más sostenibles, eficientes y seguros.
Las lacasas son enzimas ubicuas en la naturaleza y poseen una notable versatilidad, lo que permite su aplicación en diversas industrias, como la textil, papelera, alimentaria, farmacéutica y en biorremediación. Su capacidad para actuar sobre una amplia variedad de sustratos las hace especialmente atractivas en el tratamiento de efluentes y la degradación de contaminantes, desde colorantes hasta productos farmacéuticos y de cuidado personal. Sin embargo, esta misma característica representa una limitación en aplicaciones que requieren elevada selectividad, como la biocatálisis para la síntesis de compuestos específicos o el desarrollo de biosensores.
En comparación con otras oxidasas y metodologías físico-químicas, el uso de lacasas permite procesos más sostenibles, ya que su mecanismo de acción no requiere cofactores adicionales y reduce el uso de productos químicos agresivos. Si bien el creciente interés en lacasas bacterianas abre nuevas oportunidades para su producción y aplicación industrial, y el número de publicaciones científicas sobre estas enzimas ha aumentado significativamente en los últimos años, el número de patentes registradas sigue siendo limitado en relación con su potencial descrito en la literatura. Esto sugiere que, a pesar del gran interés académico, aún existen desafíos en su transferencia al sector industrial.
A pesar de las ventajas que presentan, la producción a escala industrial de lacasas bacterianas recombinantes aún enfrenta desafíos técnicos y económicos significativos. La necesidad de sistemas de expresión eficientes, procesos de purificación costeables y el cumplimiento de regulaciones estrictas constituyen barreras que limitan su adopción frente a las lacasas fúngicas, que cuentan con una trayectoria consolidada y formas recombinantes ya aprobadas y disponibles comercialmente. No obstante, el impulso global hacia tecnologías más limpias y sostenibles brinda un contexto favorable para su desarrollo. En este sentido, los recientes avances en edición génica, evolución dirigida y modelado estructural proporcionan herramientas clave para optimizar la producción y funcionalidad de estas enzimas, abriendo nuevas posibilidades para su implementación industrial.
En este escenario, la velocidad de producción de lacasas bacterianas, junto con su compatibilidad con sistemas de expresión heteróloga, las convierte en una alternativa atractiva para procesos industriales que requieren tiempos cortos de reacción o producción continua. Asimismo, la utilización de medios de cultivo económicos y la inmovilización en soportes adecuados representan estrategias prometedoras para reducir costos, aumentar la estabilidad operativa y facilitar la reutilización en procesos a escala. Si se logran superar las barreras de costo, escalabilidad y validación regulatoria, las lacasas bacterianas podrían consolidarse como una nueva generación de biocatalizadores industriales, competitivos en sostenibilidad, versatilidad y eficiencia frente a las alternativas tradicionales.
Akram, F., Ashraf, S., Haq, I. ul, Shah, F. I., & Aqeel, A. (2022). Eminent Industrial and Biotechnological Applications of Laccases from Bacterial Source: a Current Overview. Applied Biochemistry and Biotechnology, 194(5), 2336–2356. DOI: https://doi.org/10.1007/s12010-021-03781-9
Avanthi, A., & Banerjee, R. (2016). A srategic laccase mediated lignin degradation of lignocellulosic feedstocks for ethanol production. Industrial Crops and Products, 92, 174–185. DOI: https://doi.org/10.1016/j.indcrop.2016.08.009
Aza, P., & Camarero, S. (2023). Fungal Laccases: Fundamentals, Engineering and Classification Update. Biomolecules, 13(1716). DOI: https://doi.org/10.3390/biom13121716
Barrios-Estrada, C., de Jesús Rostro-Alanis, M., Muñoz-Gutiérrez, B. D., Iqbal, H. M. N., Kannan, S., & Parra-Saldívar, R. (2018). Emergent contaminants: Endocrine disruptors and their laccase-assisted degradation – A review. Science of the Total Environment, 612, 1516–1531. DOI: https://doi.org/10.1016/j.scitotenv.2017.09.013
Basheer, S., Rashid, N., Ashraf, R., Akram, M. S., Siddiqui, M. A., Imanaka, T., & Akhtar, M. (2017). Identification of a novel copper-activated and halide-tolerant laccase in Geobacillus thermopakistaniensis. Extremophiles, 21(3). DOI: https://doi.org/10.1007/s00792-017-0925-3
Betancor, L., Johnson, G.R. & Luckarift, H.R. (2013). Stabilized Laccases as Heterogeneous Bioelectrocatalysts. ChemCatChem, 5, 46-60. DOI: https://doi.org/10.1002/cctc.201200611
Bourbonnais, R., & Paice, M. G. (1990). Oxidation of non-phenolic substrates: An expanded role for laccase in lignin biodegradation. FEBS Letters, 267(1), 99–102. DOI: https://doi.org/10.1016/0014-5793(90)80298-W
Britos, C. N., Gianolini, J. E., Portillo, H., & Trelles, J. A. (2018). Biodegradation of industrial dyes by a solvent, metal and surfactant-stable extracellular bacterial laccase. Biocatalysis and Agricultural Biotechnology, 14, 221–227. DOI: https://doi.org/10.1016/j.bcab.2018.03.015
Britos, C. N., & Trelles, J. A. (2016). Development of strong enzymatic biocatalysts for dye decolorization. Biocatalysis and Agricultural Biotechnology, 7, 228–233. DOI: https://doi.org/10.1016/j.bcab.2016.06.009
Camarero, S., Ibarra, D., Martınez, M. J., & Martınez, A. T. (2005). Lignin-Derived Compounds as Efficient Laccase Mediators for decolorization of recalcitrant dye.pdf. Appl. Environ. Microbiol., 71(4), 1775–1784. DOI: https://doi.org/10.1128/AEM.71.4.1775–1784.2005
Campaña, A. L., Florez, S. L., Noguera, M. J., Fuentes, O. P., Puentes, P. R., Cruz, J. C., & Osma, J. F. (2019). Enzyme-based Electrochemical Biosensors for Microfluidic Platforms to Detect Pharmaceutical Residues in Wastewater. Biosensors, 9(41).
Cardullo, N., Muccilli, V., & Tringali, C. (2022). Laccase-mediated synthesis obf bioactive natural procuts and their analogues. RSC Chemical Biology, 3, 614-647.
Ciullini, I., Tilli, S., Scozzafava, A., & Briganti, F. (2008). Fungal laccase, cellobiose dehydrogenase, and chemical mediators: Combined actions for the decolorization of different classes of textile dyes. Bioresource Technology, 99(15), 7003–7010. DOI: https://doi.org/10.1016/j.biortech.2008.01.019
Colella, A., De Chiaro, A., & Lettera, V. (2021). In Situ Wood Fiber Dyeing Through Laccase Catalysis for Fiberboard Production. Frontiers in Bioengineering and Biotechnology, 9. DOI: https://doi.org/10.3389/fbioe.2021.778971
Davies, G. J., & Ducros, V. (2002). Laccase. In A. Messerschmidt, R. Huber, T. Poulos, & K. Wieghardt (Eds.). Handbook of metalloproteins. John Wiley & Sons.
Deng, J., Wang, H., Zhan, H., Wu, C., Huang, Y., Yang, B., Mosa, A., & Ling, W. (2022). Catalyzed degradation of polycyclic aromatic hydrocarbons by recoverable magnetic chitosan immobilized laccase from Trametes versicolor. Chemosphere, 301, 134753. DOI: https://doi.org/10.1016/J.CHEMOSPHERE.2022.134753
Desai, S. S., & Nityanand, C. (2011). Microbial laccases and their applications: A review. Asian Journal of Biotechnology, 3(2), 98–124. DOI: https://doi.org/10.3923/ajbkr.2011.98.124
Deska, M., & Kończak, B. (2019). Immobilized fungal laccase as “green catalyst” for the decolourization process – State of the art. Process Biochemistry, 84(May), 112–123. DOI: https://doi.org/10.1016/j.procbio.2019.05.024
Dijkstra, L., & Walker, J. R. L. (1991). Enzymic browning in apricots (Prunus armeniaca). Journal of the Science of Food and Agriculture, 54(2), 229–234. DOI: https://doi.org/10.1002/jsfa.2740540208
Du, Y., Oshima, R., & Kumanotani, J. (1984). Reversed-phase liquid chromatographic separation and identification of constituents of uroshiol in the sap of the lac tree, Rhus vernicifera. Journal of Chromatography A, 284(C), 463–473. DOI: https://doi.org/10.1016/S0021-9673(01)87848-1
Ejembi, F. O., Çağıl, Ö., Ameh, L., Ameh, E. G., Ajifken, J., Asoh, L., & Soya, D. D. (2022). Biodegradation and treatment of Olive Mill Wastewater with fungi (Laccase). International Journal of Advances in Engineering and Management (IJAEM), 4(12).
Elnashar, M. M. M. (2010). Review Article: Immobilized Molecules Using Biomaterials and Nanobiotechnology. Journal of Biomaterials and Nanobiotechnology, 1, 61–77. DOI: https://doi.org/10.4236/jbnb.2010.11008
Enguita, F. J., Martins, L. O., Henriques, A. O., & Carrondo, M. A. (2003). Crystal structure of a bacterial endospore coat component: A laccase with enhanced thermostability properties. Journal of Biological Chemistry, 278(21), 19416–19425.
Fabbrini, M., Galli, C., & Gentili, P. (2002). Comparing the catalytic efficiency of some mediators of laccase. Journal of Molecular Catalysis B: Enzymatic, 16(5–6), 231–240. DOI: https://doi.org/10.1016/S1381-1177(01)00067-4
Garavaglia, S., Cambria, M. T., Miglio, M., Ragusa, S., Iacobazzi, V., Palmieri, F., D’Ambrosio, C., Scaloni, A., & Rizzi, M. (2004). The structure of Rigidoporus lignosus laccase containing a full complement of copper ions, reveals an asymmetrical arrangement for the T3 copper pair. Journal of Molecular Biology, 342(5), 1519–1531. DOI: https://doi.org/10.1016/j.jmb.2004.07.100
Gianfreda, L., Xu, F., & Bollag, J. M. (1999). Laccases: A useful group of oxidoreductive enzymes. Bioremediation Journal, 3(1), 1–26. DOI: https://doi.org/10.1080/10889869991219163
Gianolini, J. E., Britos, C. N., Mulreedy, C. B., & Trelles, J. A. (2020). Hyperstabilization of a thermophile bacterial laccase and its application for industrial dyes degradation. 3 Biotech, 10(6), 1–7. DOI: https://doi.org/10.1007/s13205-020-02277-3
Giardina, P., Faraco, V., Pezzella, C., Piscitelli, A., Vanhulle, S., & Sannia, G. (2010). Laccases: A never-ending story. Cellular and Molecular Life Sciences, 67(3), 369–385. DOI: https://doi.org/10.1007/s00018-009-0169-1
Givaudan, A., Effosse, A., Faure, D., Potier, P., Bouillant, M.-L., & Bally, R. (1993). Polyphenol oxidase in Azospirillum lipoferum isolated from rice rhizosphere: Evidence for laccase activity in non-motile strains of Azospirillum lipoferum. In FEMS Microbiology Letters (Vol. 108). DOI: https://doi.org/10.1111/j.1574-6968.1993.tb06100.x
Gupta, V., Balda, S., Gupta, N., Capalash, N., & Sharma, P. (2019). Functional substitution of domain 3 (T1 copper center) of a novel laccase with Cu ions. International Journal of Biological Macromolecules, 123, 1052–1061. DOI: https://doi.org/10.1016/j.ijbiomac.2018.11.174
Guzik, U., Hupert-Kocurek, K., & Wojcieszynska, D. (2014). Immobilization as a strategy for improving enzyme properties- Application to oxidoreductases. Molecules, 19(7), 8995–9018. DOI: https://doi.org/10.3390/molecules19078995
Hakulinen, N., Kiiskinen, L. L., Kruus, K., Saloheimo, M., Paanen, A., Koivula, A., & Rouvinen, J. (2002). Crystal structure of a laccase from Melanocarpus albomyces with an intact trinuclear copper site. Nature Structural Biology, 9(8), 601–605. DOI: https://doi.org/10.1038/nsb823
Heckmann, C. M., & Paradisi, F. (2020). Looking Back: A Short History of the Discovery of Enzymes and How They Became Powerful Chemical Tools. ChemCatChem, 12(24), 6082–6102. DOI: https://doi.org/10.1002/cctc.202001107
Hoopes, J. T., & Dean, J. F. D. (2004). Ferroxidase activity in a laccase-like multicopper oxidase from Liriodendron tulipifera. Plant Physiology and Biochemistry, 42(1), 27–33. DOI: https://doi.org/10.1016/j.plaphy.2003.10.011
Ibarra, D., Eugenio, M. E., Alvira, P., Ballesteros, I., Ballesteros, M., & Negro, M. J. (2023). Effect of Laccase Detoxification on Bioethanol Production from Liquid Fraction of Steam-Pretreated Olive Tree Pruning. Fermentation, 9(214).
Jayakrishnan, A., Wan Rosli, W. R., Tahir, A. R. M., Razak, F. S. A., Kee, P. E., Ng, H. S., Chew, Y.-L., Lee, S. K., Ramasamy, M., Tan, C. S., & et al. (2024). Evolving paradigms of recombinant protein production in pharmaceutical industry: A rigorous review. Sci, 6(1), 9. DOI: https://doi.org/10.3390/sci6010009
Jin, X., Yu, X., Zhu, G., Zheng, Z., Feng, F., & Zhang, Z. (2016). Conditions Optimizing and Application of Laccase-Mediator System (LMS) for the Laccase-catalyzed Pesticide Degradation. Scientific Reports, 6(35787).
Kadam, A. A., Saratale, G. D., Ghodake, G. S., Saratale, R. G., Shahzad, A., Magotra, V. K., Kumar, M., Palem, R. R., & Sung, J. S. (2022). Recent Advances in the Development of Laccase-Based Biosensors via Nano-Immobilization Techniques. Biosensors, 10(58).
Kafeel, M., Ansari, A., Lastochkina, O., Iqbal, M., Ansari, A. A., Fatma, T., Rodriguez-Couto, S., & Owens, G. (2021). Laccase-The Wonder Enzyme for a Variety of Industries. Acta Scientific MICROBIOLOGY, 4(12), 2581–3226.
Kudanga, T. (2024). Bacterial laccases: a general introduction. In D. Yadav & T. Kudanga (Eds.), Bacterial laccases. Engineering, Immobilization, Heterologous Production, and Industrial Applications (pp. 1–9). Academic Press. DOI: https://doi.org/https://doi.org/10.1016/C2021-0-00202-9
Kumar, M., Mishra, A., Singh, S. S., Srivastava, S., & Thakur, I. S. (2018). Expression and characterization of novel laccase gene from Pandoraea sp. ISTKB and its application. International Journal of Biological Macromolecules, 115, 308–316. DOI: https://doi.org/10.1016/j.ijbiomac.2018.04.079
Kumar, S. V. S., Phale, P. S., Durani, S., & Wangikar, P. P. (2003). Combined sequence and structure analysis of the fungal laccase family. Biotechnology and Bioengineering, 83(4), 386–394. DOI: https://doi.org/10.1002/bit.10681
Kunamneni, A., Ballesteros, A., Plou, F. J., & Alcalde, M. (2007). Fungal laccase – a versatile enzyme for biotechnological applications. Applied Microbiology, 233–245.
Lapponi, M. J., Méndez, M. B., Trelles, J. A., & Rivero, C. W. (2022). Cell immobilization strategies for biotransformations. Current Opinion in Green and Sustainable Chemistry, 33, 100565. DOI: https://doi.org/10.1016/j.cogsc.2021.100565
Leontievsky, A., Myasoedova, N., Pozdnyakova, N., & Golovleva, L. (1997). “Yellow” laccase of Panus tigrinus oxidizes non-phenolic substrates without electron-transfer mediators. FEBS Letters, 413, 446–448. DOI: https://doi.org/10.1016/S0014-5793(97)00953-8
Li, S., Qi, B., Luo, J., & Wan, Y. (2022). Degradation of phenolic inhibitors by laccase immobilized on tannic acid/polyethylenimine modified magnetic nanoparticles. Results in Engineering, 15. DOI: https://doi.org/10.1016/j.rineng.2022.100585
Li, T., Wang, H., Li, J., Jiang, L., Kang, H., Guo, Z., Wang, C., Yang, W., Liu, F., Lu, F., & Liu, Y. (2021). Enzymatic characterization, molecular dynamics simulation, and application of a novel Bacillus licheniformis laccase. International Journal of Biological Macromolecules, 167, 1393–1405. DOI: https://doi.org/10.1016/j.ijbiomac.2020.11.093
Lin, J.-W., Jiang, G.-L., Liang, C.-X., Li, Y.-M., Chen, X.-Y., Zhang, X.-T., & Tang, Z.-S. (2023). Laccase-Induced Gelation of Sugar Beet Pectin–Curcumin Nanocomplexes Enhanced by Genipin Crosslinking. Foods, 12(14), 2771. DOI: https://doi.org/10.3390/foods12142771
Luo, Q., Chen, Y., Xia, J., Wang, K. Q., Cai, Y. J., Liao, X. R., & Guan, Z. B. (2018). Functional expression enhancement of Bacillus pumilus CotA-laccase mutant WLF through site-directed mutagenesis. Enzyme and Microbial Technology, 109(July 2017), 11–19. DOI: https://doi.org/10.1016/j.enzmictec.2017.07.013
Madhavi, V., & Lele, S. S. (2009). Laccase: Properties and applications. BioResources, 4(4), 1694–1717. DOI: https://doi.org/10.15376/biores.4.4.1694-1717
Maghraby, Y. R., El-Shabasy, R. M., Ibrahim, A. H., Mohamed, H., & Azzazy, E.-S. (2023). Enzyme Immobilization Technologies and Industrial Applications. 8, 5184–5196. DOI: https://doi.org/10.1021/acsomega.2c07560
Majcherczyk, A., & Johannes, C. (2000). Radical mediated indirect oxidation of a PEG-coupled polycyclic aromatic hydrocarbon (PAH) model compound by fungal laccase. Biochimica et Biophysica Acta - General Subjects, 1474(2), 157–162. DOI: https://doi.org/10.1016/S0304-4165(00)00012-X
Mate, D. M., & Alcalde, M. (2017). Laccase: a multi-purpose biocatalyst at the forefront of biotechnology. Microbial Biotechnology, 10(6), 1457–1467. DOI: https://doi.org/10.1111/1751-7915.12422
Mayolo-Deloisa, K., González-González, M., & Rito-Palomares, M. (2020). Laccases in Food Industry: Bioprocessing, Potential Industrial and Biotechnological Applications. Frontiers in Bioengineering and Biotechnology, 8(March), 1–8. DOI: https://doi.org/10.3389/fbioe.2020.00222
Minussi, R. C., Pastore, G. M., & Durán, N. (2002). Potential applications of laccase in the food industry. Trends in Food Science and Technology, 13(6–7), 205–216. DOI: https://doi.org/10.1016/S0924-2244(02)00155-3
Mita, N., Tawaki, S. Ichiro, Hiroshi, U., & Kobayashi, S. (2003). Laccase-catalyzed oxidative polymerization of phenols. Macromolecular Bioscience, 3(5), 253–257. DOI: https://doi.org/10.1002/mabi.200390032
Mohamad, N. R., Marzuki, N. H. C., Buang, N. A., Huyop, F., & Wahab, R. A. (2015). An overview of technologies for immobilization of enzymes and surface analysis techniques for immobilized enzymes. Biotechnology and Biotechnological Equipment, 29(2), 205–220. DOI: https://doi.org/10.1080/13102818.2015.1008192
Morozova, O. V, Shumakovich, G. P., Gorbacheva, M. A., Shleev, S. V, & Yaropolov, A. I. (2007). “Blue” Laccases. Biochemistry, 72(10), 1136–1150.
Muthu, S., & Khadir, A. (2021). Dye Biodegradation, Mechanisms and Techniques. Recent Advances. In S. Senthilkannan Muthu & A. Khadir (Eds.), Sustainable Textiles: Production, Processing, Manufacturing & Chemistry. Springer Nature. DOI: https://doi.org/10.1007/978-981-16-5932-4
Niladevi, K. N., & Prema, P. (2008). Immobilization of laccase from Streptomyces psammoticus and its application in phenol removal using packed bed reactor. World Journal of Microbiology and Biotechnology, 24(7), 1215–1222. DOI: https://doi.org/10.1007/s11274-007-9598-x
Othman, A. M., Rodriguez-Couto, S., & Mechichi, T. (2022). Editorial: Microbial Laccases: Recent Advances and Biotechnological Applications. Frontiers in Bioengineering and Biotechnology, 10(May), 1–2. DOI: https://doi.org/10.3389/fbioe.2022.922223
Ottoni, C., do Valle Trotta, C., Martins, G., Matos, J., Maiorano, A. E., Brito, A. G., Peixoto, L.(2023). In Situ Trametes versicolor Laccase Biocathode Performance Assessment in Dual-Chamber Microbial Fuel Cells. Bioenerg. Res. 16, 2616–2624. DOI: https://doi.org/10.1007/s12155-023-10594-7
Pannu, J. S., & Kapoor, R. K. (2014). Microbial Laccases: a mini-review on their production, purification and applications. International Journal of Pharmaceutical Archive, 3(12), 528–536.
Panwar, V., Dey, B., Sheikh, J. N., & Dutta, T. (2022). Thermostable bacterial laccase for sustainable dyeing using plant phenols. RSC Advances, 12(28), 18168–18180. DOI: https://doi.org/10.1039/d2ra02137d
Pawlik, A., Wójcik, M., Rułka, K., Motyl-Gorzel, K., Osińska-Jaroszuk, M., Wielbo, J., Marek-Kozaczuk, M., Skorupska, A., Rogalski, J., & Janusz, G. (2016). Purification and characterization of laccase from Sinorhizobium meliloti and analysis of the lacc gene. International Journal of Biological Macromolecules, 92, 138–147. DOI: https://doi.org/10.1016/j.ijbiomac.2016.07.012
Piscitelli, A., Pezzella, C., Giardina, P., Faraco, V., & Giovanni, S. (2010). Heterologous laccase production and its role in industrial applications. Bioengineered Bugs, 1(4), 252–262. DOI: https://doi.org/10.4161/bbug.1.4.11438
Prajapati, C. D., Smith, E., Kane, F., & Shen, J. (2018). Laccase-catalysed coloration of wool and nylon. Coloration Technology, 134, 423–439. DOI: https://doi.org/10.1111/cote.12350
Prins, A., Kleinsmidt, L., Khan, N., Kirby, B., Kudanga, T., Vollmer, J., Pleiss, J., Burton, S., & Le Roes-Hill, M. (2015). The effect of mutations near the T1 copper site on the biochemical characteristics of the small laccase from Streptomyces coelicolor A3(2). Enzyme and Microbial Technology, 68, 23–32. DOI: https://doi.org/10.1016/j.enzmictec.2014.10.003
Riva, S. (2006). Laccases: blue enzymes for green chemistry. Trends in Biotechnology, 24(5), 219–226. DOI: https://doi.org/10.1016/j.tibtech.2006.03.006
Sajeevan, S., Michel, H., Jose, J., & Bhat, S. G. (2024). Immobilization for enhancement of laccase reusability. In D. Yadav & T. Kudanga (Eds.), Bacterial laccases. Engineering, Immobilization, Heterologous Production, and Industrial Applications (pp. 125–140). Academic Press.
Santhanam, N., Vivanco, J. M., Decker, S. R., & Reardon, K. F. (2011). Expression of industrially relevant laccases: Prokaryotic style. Trends in Biotechnology, 29(10), 480–489. DOI: https://doi.org/10.1016/j.tibtech.2011.04.005
Shao, X., Gao, Y., Jiang, M., & Li, L. (2009). Deletion and site-directed mutagenesis of laccase from Shigella dysenteriae results in enhanced enzymatic activity and thermostability. Enzyme and Microbial Technology, 44(5), 274–280. DOI: https://doi.org/10.1016/j.enzmictec.2008.12.013
Sheldon, R. A., & van Pelt, S. (2013). Enzyme immobilisation in biocatalysis: why, what and how. Chem. Soc. Rev., 42(15), 6223–6235. DOI: https://doi.org/10.1039/C3CS60075K
Shin, S. K., Hyeon, J. E., Joo, Y. C., Jeong, D. W., You, S. K., & Han, S. O. (2019). Effective melanin degradation by a synergistic laccase-peroxidase enzyme complex for skin whitening and other practical applications. International Journal of Biological Macromolecules, 129, 181–186. DOI: https://doi.org/10.1016/j.ijbiomac.2019.02.027
Shraddha, Shekher, R., Sehgal, S., Kamthania, M., & Kumar, A. (2011). Laccase: Microbial Sources, Production, Purification, and Potential Biotechnological Applications. Enzyme Research, 2011, 1–11. DOI: https://doi.org/10.4061/2011/217861
Sigrist, C. J. A., de Castro, E., Cerutti, L., Cuche, B., Hulo, N., Bridge, A., Bougueleret, L., & Xenarios, I. (2013). New and continuing developments at PROSITE. Nucleic Acids Research, 41. DOI: https://doi.org/10.1093/nar/gks1067
Singh, G., & Arya, S. K. (2019). Utility of laccase in pulp and paper industry: A progressive step towards the green technology. In International Journal of Biological Macromolecules (Vol. 134). Elsevier B.V. DOI: https://doi.org/10.1016/j.ijbiomac.2019.05.168
Singh, G., Bhalla, A., Kaur, P., Capalash, N., & Sharma, P. (2011). Laccase from prokaryotes: A new source for an old enzyme. Reviews in Environmental Science and Biotechnology, 10(4), 309–326. DOI: https://doi.org/10.1007/s11157-011-9257-4
Šrédlová, K., Šírová, K., Stella, T., & Cajthaml, T. (2021). Degradation products of polychlorinated biphenyls and their in vitro transformation by ligninolytic fungi. Toxics, 9(4). DOI: https://doi.org/10.3390/toxics9040081
Srinivasan, P., Selvankumar, T., Paray, B. A., Rehman, M. U., Kamala-Kannan, S., Govarthanan, M., Kim, W., & Selvam, K. (2020). Chlorpyrifos degradation efficiency of Bacillus sp. laccase immobilized on iron magnetic nanoparticles. 3 Biotech, 10(8). DOI: https://doi.org/10.1007/s13205-020-02363-6
Torres, E., Bustos-Jaimes, I., & Le Borgne, S. (2003). Potential use of oxidative enzymes for the detoxification of organic pollutants. In Applied Catalysis B: Environmental (Vol. 46, Issue 1, pp. 1–15). Elsevier. DOI: https://doi.org/10.1016/S0926-3373(03)00228-5
Trelles, J. A., & Rivero, C. W. (2020). Whole Cell Entrapment Techniques. In J. Guisan, J. Bolivar, F. López-Gallego, & J. Rocha-Martín (Eds.), Immobilization of Enzymes and Cells. Methods in Molecular Biology (pp. 385–394). Humana Press. DOI: https://doi.org/https://doi.org/10.1007/978-1-0716-0215-7_25
Valderrama, B., Oliver, P., Medrano-Soto, A., & Vazquez-Duhalt, R. (2003). Evolutionary and structural diversity of fungal laccases. Antonie van Leeuwenhoek, 84(4), 289–299. DOI: https://doi.org/10.1023/A:1026070122451
Verma, A., Shirkot, P., Dhiman, K., Sharma, R., & Chauhan, A. (2018). First Evidence of a Potential Antimicrobial Activity of Bacterial Laccase Against Various Plant Pathogens. National Academy Science Letters, 42(1), 5–8. DOI: https://doi.org/10.1007/s40009-018-0695-1
Vogel, A., & May, O. (2019). Industrial Enzyme Applications. In Resources and Applications of Biotechnology. Wiley-VCH Verlag GmbH& Co. KGaA. https://doi.org/10.1002/9783527813780
Vojnovic, S., Aleksic, I., Ilic-Tomic, T., Stevanovic, M., & Nikodinovic-Runic, J. (2024). Bacillus and Streptomyces spp. as hosts for production of industrially relevant enzymes. Applied Microbiology and Biotechnology, 108(1). https://doi.org/10.1007/s00253-023-12900-x
Xia, T. T., Feng, M., Liu, C. L., Liu, C. Z., & Guo, C. (2021). Efficient phenol degradation by laccase immobilized on functional magnetic nanoparticles in fixed bed reactor under high-gradient magnetic field. Engineering in Life Sciences, 21(6), 374–381. DOI: https://doi.org/10.1002/elsc.202100009
Xu, F., Palmer, A. E., Yaver, D. S., Berka, R. M., Gambetta, G. A., Brown, S. H., & Solomon, E. I. (1999). Targeted mutations in a Trametes villosa laccase: Axial perturbations of the T1 copper. Journal of Biological Chemistry, 274(18), 12372–12375. DOI: https://doi.org/10.1074/jbc.274.18.12372
Zerva, A., Simić, S., Topakas, E., & Nikodinovic-Runic, J. (2019). Applications of microbial laccases: Patent review of the past decade (2009–2019). Catalysts, 9(12), 1–25. DOI: https://doi.org/10.3390/catal9121023
Zhang, Y., Plesner, T. J., Ouyang, Y., Zheng, Y. C., Bouhier, E., Berentzen, E. I., Zhang, M., Zhou, P., Zimmermann, W., Andersen, G. R., Eser, B. E., & Guo, Z. (2023). Computer-aided discovery of a novel thermophilic laccase for low-density polyethylene degradation. Journal of Hazardous Materials, 458. DOI: https://doi.org/10.1016/j.jhazmat.2023.131986

