Importancia de las aldolasas en la síntesis de productos anticolesterolémicos
Aldolases: useful enzymes for the synthesis of anticholesterolemic products
Adolfo Iribarren Elizabeth Lewkowicz Romina Fernández VarelaLa biocatálisis es el uso de productos biológicos o sus derivados como biocatalizadores en la síntesis de productos químicos de interés. Debido a que las reacciones biocatalizadas pueden realizarse en condiciones suaves de reacción, esta disciplina surge como una alternativa sustentable a la química orgánica convencional. Desde hace unos años, varios procesos químicos empezaron a sustituirse por procesos biocatalizados (Schmid et al., 2001). Quizás la mayor ventaja del uso de biocatalizadores sea la simplicidad de llevar a cabo reacciones orgánicas con precisión química (Rozzell, 1999). Tal precisión hace referencia a que las enzimas son quimio- regio- y estéreoselectivas, es decir, son capaces de modificar el sustrato en un grupo funcional en particular, en una posición y en una configuración determinada. Las reacciones biocatalizadas se realizan, generalmente, en medios acuosos, lo que disminuye la energía utilizada y crea una baja cantidad de residuos durante su desarrollo (Frazzetto, G., 2003), haciendo que el proceso sea ecológicamente sustentable y más eficiente en tiempo y costo.
Nuestro laboratorio ha realizado importantes avances en cuanto a la utilización de un grupo de enzimas denominado aldolasas. Estas enzimas pertenecen al grupo de las liasas y son biocatalizadores efectivos para realizar reacciones de adición aldólica en medios acuosos, con elevado rendimiento y alta estereoselectividad. Las aldolasas pueden clasificarse según su mecanismo de reacción en clase I o II. En las aldolasas de la clase I se genera una base de Schiff entre un residuo conservado de lisina correspondiente al sitio activo y el sustrato dador nucleofílico, lo que posibilita la activación del sustrato. Las aldolasas de clase II son dependientes de cofactores metálicos, los cuales actúan como ácidos de Lewis y activan al sustrato dador nucleofílico formando un enolato. Teniendo en cuenta que las aldolasas son fuertemente dependientes del sustrato dador nucleofílico es posible clasificarlas también según esta característica. Es por ello que podemos encontrar aldolasas dependientes de acetaldehído, de dihidroxiacetona fosfato, de dihidroxiacetona, de piruvato o de glicina (Kullartz et al., 2012).
2-Desoxirribosa-5-fosfato aldolasa (DERA), es una aldolasa de clase I perteneciente al grupo dependiente de acetaldehído. DERA cataliza la adición aldólica reversible entre el gliceraldehido-3-fosfato (G3P) y el acetaldehído para generar 2-desoxirribosa-5-fosfato (DR5P) Esquema 1. Esta enzima es la única reportada que acepta dos aldehídos como sustratos, lo que posibilita generar reacciones de adición aldólica consecutivas y la obtención de estructuras importantes para la industria química. Por ejemplo, se ha reportado el uso de esta enzima como parte de la ruta de síntesis de (R)-1,3-butanediol un compuesto utilizado en las industrias farmacológica y cosmética (Nemr et al., 2018). Existen en bibliografía varios procesos biocatalíticos que utilizan DERA para la síntesis de productos farmacéuticos activos con rendimientos elevados. Un ejemplo destacado es la síntesis de precursores de estatinas, drogas utilizadas para el control de la colesterolemia. Dichas moléculas comúnmente están formadas por un anillo heterocíclico aromático que contiene nitrógeno, y una cadena lateral derivada del ácido (3R, 5R)-3,5-dihidroxiheptanoico Esquema 2. La acción farmacológica de las estatinas es la inhibición irreversible de la enzima 3-hidroxi-3-metilglutaril-coenzima A (HMGCoA) reductasa, involucrada en la biosíntesis intracelular del colesterol (Lennernäs et al. 1997). Debido a que las estatinas provocan efectos secundarios no deseados – diarrea, dolor de articulaciones, acidez, etc. – existe una búsqueda constante para sintetizar estatinas modificadas novedosas.
Dado que la reacción natural DERA es la hidrólisis de DR5P, para desplazar el equilibrio hacia la síntesis es necesario aumentar la concentración del sustrato dador nucleofílico. Sin embargo, una de las desventajas de DERA es que se inhibe cuando se encuentra en presencia de una elevada concentración de acetaldehído. Es por ello que es de importancia encontrar nuevos microorganismos tolerantes a alta cantidad de este sustrato. Se han reportado en bibliografía microorganismos con actividad DERA capaces de realizar reacciones de síntesis de DR5P en concentraciones de acetaldehído mayores a 200mM (Lou et al. 2019), presentando rendimientos elevados para esta reacción. En estudios previos realizados en el laboratorio, se ha seleccionado una bacteria – Pectobacterium atrosepticum– con actividad DERA capaz de realizar adiciones aldólicas con un buen rendimiento, en presencia de elevadas concentraciones acetaldehído (Valino et al. 2012). El gen DERA perteneciente a esta bacteria ha sido sobre-expresado en el marco de un proyecto de la Unión Europea, al cual pertenece el Laboratorio de Biocatálisis y Biotransformaciones.1 Actualmente, en el laboratorio, se están realizando estudios de actividad de esta enzima con resultados prometedores. Empleando diversos aldehídos como sustratos electrofílicos se espera, mediante un camino quimio-enzimático, generar nuevos análogos de estatinas cuya actividad será estudiada.
Esquema 3.
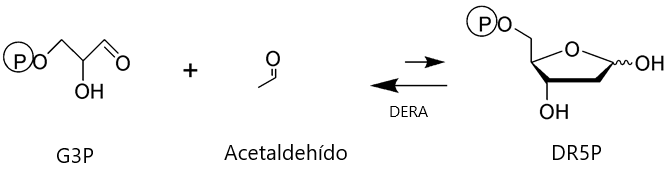
Esquema 1: Reacción de adición aldólica entre G3P (aceptor electrofílico) y acetaldehído (dador nucleofílico) biocatalizada por DERA.
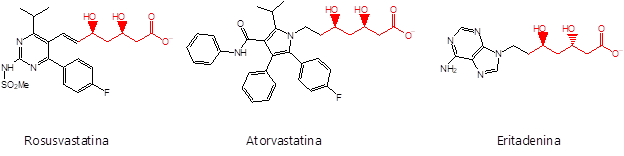
Esquema 2: Ejemplos de estatinas comerciales
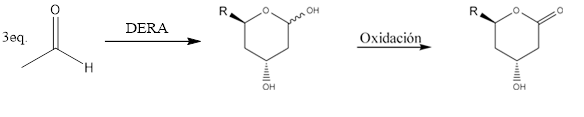
Esquema 3: nuevos análogos de estatinas
Notas
- Proyecto ERA CoBioTechBioDiMet - ID: 140, UE-MinCyT; Programa Biocatálisis y Biotransformaciones, Universidad Nacional de Quilmes, Argentina; CONICET
Kullartz, I., & Pietruszka, J. (2012). Cloning and characterisation of a new 2-deoxy-d-ribose-5-phosphate aldolase from Rhodococcus erythropolis. Journal of biotechnology, 161(2), 174-180.
Lennernäs, H., & Fager, G. (1997). Pharmacodynamics and pharmacokinetics of the HMG-CoA reductase inhibitors. Clinical pharmacokinetics, 32(5), 403-425.
Lou, X. C., Zheng, C. C., Chen, W. Q., Ma, Y. X., Mkingule, I., He, F. F., & Fei, H. (2019). Heterologous expression and characterization of novel 2-Deoxy-d-ribose-5-phosphate aldolase (DERA) from Pyrobaculumcalidifontis and Meiothermusruber. Process Biochemistry.
Nemr, K., Müller, J. E., Joo, J. C., Gawand, P., Choudhary, R., Mendonca, B., ... &Mahadevan, R. (2018). Engineering a short, aldolase-based pathway for (R)-1, 3-butanediol production in Escherichia coli. Metabolic engineering, 48, 13-24.
Rozzell, J. D. (1999). Commercial scale biocatalysis: myths and realities. Bioorganic & medicinal chemistry, 7(10), 2253-2261.
Schmid, A., Dordick, J. S., Hauer, B., Kiener, A., Wubbolts, M., &Witholt, B. (2001). Industrial biocatalysis today and tomorrow. Nature, 409(6817), 258-268.
Valino, A. L., Palazzolo, M. A., Iribarren, A. M., & Lewkowicz, E. (2012). Appl Biochem Biotech, 166(2), 300-308.

