Dendrímeros como nanotransportadores de drogas y como drogas per se
Dendrimer as drug-nanotransporters and as drug per se
Daniela E. IgartúaLos dendrímeros, también conocidos como moléculas en cascada, son polímeros tridimensionales obtenidos por síntesis orgánica que consisten en un core central, ramificaciones unidas covalentemente al core que crecen radialmente formando generaciones (G) y una superficie con múltiples grupos terminales (Figura 1). El término “dendrímero” surge de las palabras griegas dendron y meros, que significan árbol y partes, respectivamente, haciendo referencia a la estructura ramificada de estas macromoléculas (Jain, Kesharwani, Gupta, & Jain, 2010). Los dendrímeros podrían ser definidos entonces como macromoléculas sintéticas complejas, con estructura ramificada, forma tridimensional controlada y tamaño en el rango nanométrico (Markowicz-Piasecka & Mikiciuk-Olasik, 2016).
Estas macromoléculas fueron sintetizadas en los 80s por el grupo de Donald Tomalia (Tomalia et al., 1985), e independientemente por el grupo de George Newkome (Newkome, Yao, Baker, & Gupta, 1985). Particularmente, los dendrímeros, sus propiedades y sus aplicaciones se volvieron un campo de investigación interesante en 1983, cuando Tomalia describió por la síntesis de estos polímeros en la Winter Polymer Gordon Conference. Este investigador y su grupo sintetizaron la primera familia de dendrímeros a partir de un core de etilendiamina al que fueron adicionando cadenas ramificadas de poliamidoamina (PAMAM) desde la generación cero (G0) hasta la G10. Estos dendrímeros se conocen como dendrímeros PAMAM o Starburst ® (Tomalia et al., 1985), y son uno de los múltiples tipos de dendrímeros que se han sintetizado hasta el momento con distintos core, tipos de ramificaciones y grupos terminales.
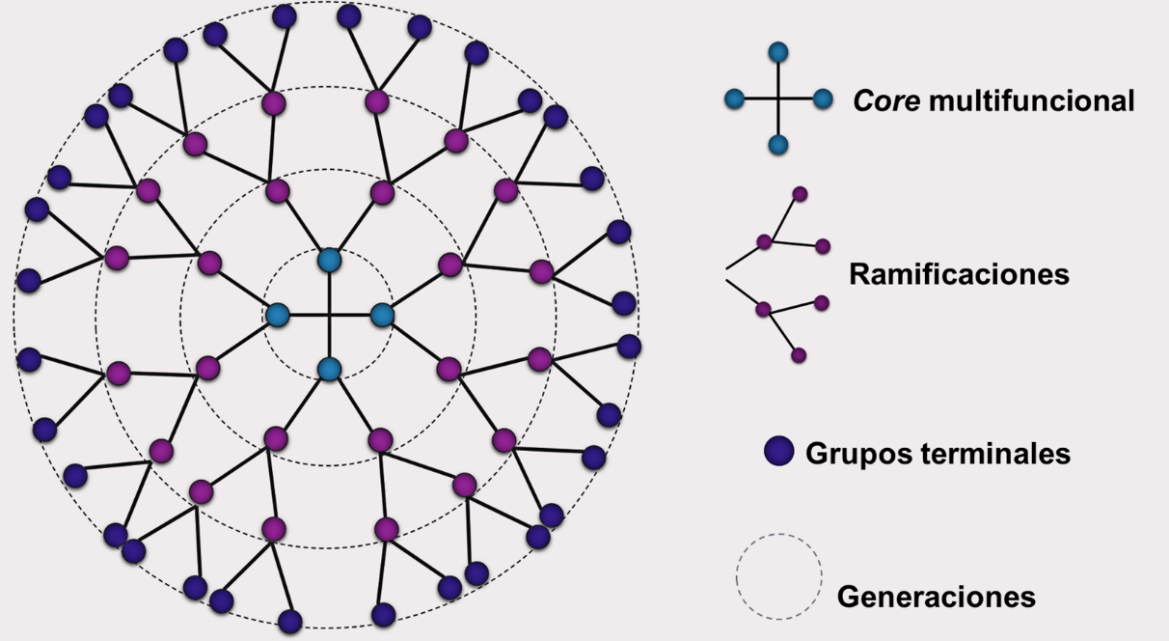
Figura 1 – Representación en dos dimensiones de un dendrímero.
Se puede observar el crecimiento radial, a partir del core multifuncional, de las ramificaciones que dan lugar a las distintas generaciones.
En todos los tipos de dendrímeros, a medida que crece desde el core hacia la superficie, por adición progresiva de las capas conocidas como generaciones, el tamaño se incrementa gradualmente (aproximadamente 1 nm/G) y también se incrementa el número de grupos internos y superficiales (Figura 2). Además, a medida que se incrementa el número de generaciones, los dendrímeros se vuelven más esféricos y la densidad de grupos superficiales se incrementa (D’Emanuele & Attwood, 2005). Por ejemplo, los dendrímeros PAMAM con core de etilendiamina incrementan su tamaño de 1,1 a 12,4 nm desde la G1 a la G10, mientras que el número de grupos terminales aumenta de 8 a 16384.
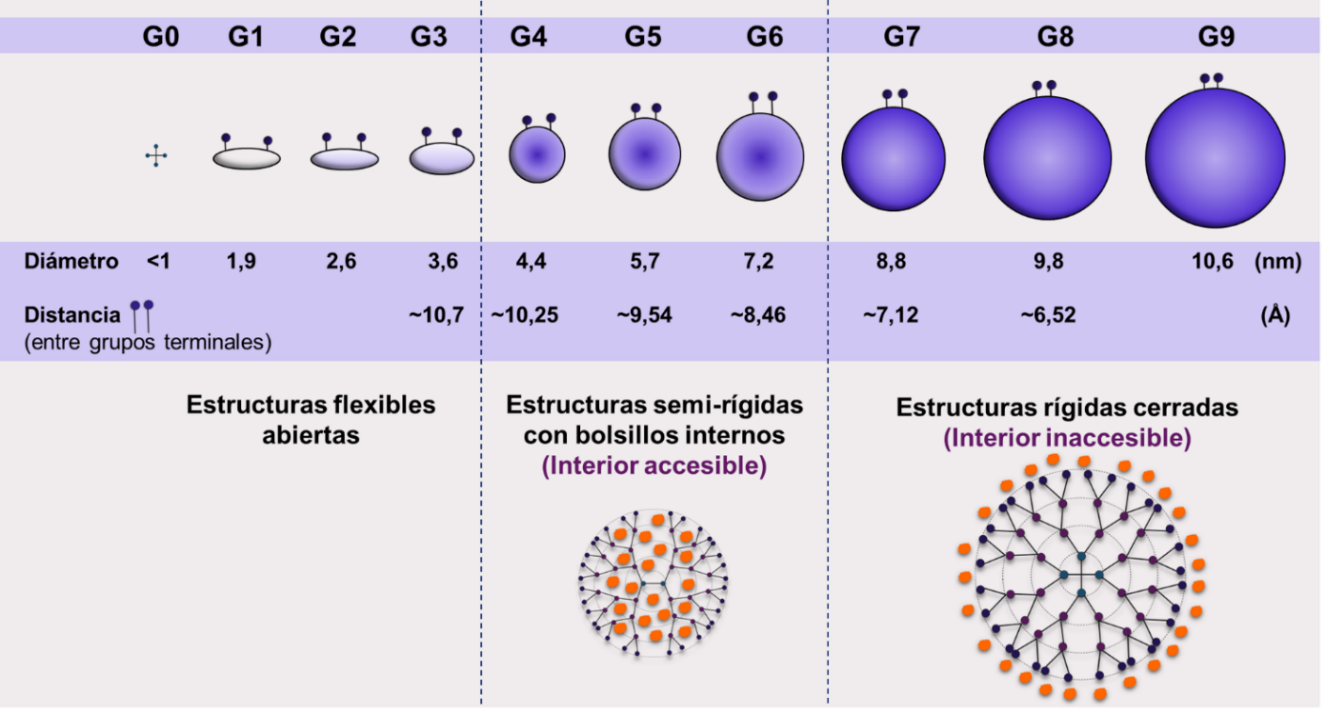
Figura 2 – Representación estructural de dendrímeros PAMAM desde la G0 a G10.
Se puede observar el incremento gradual en el tamaño de los dendrímeros y la disminución en la distancia entre sus grupos superficiales (aumenta la densidad en la superficie junto con la G).
Ciertas propiedades fisicoquímicas de los dendrímeros, como la solubilidad o la reactividad, están determinadas por la naturaleza de sus grupos terminales superficiales. A diferencia de los polímeros convencionales, con solo dos extremos terminales, el número de grupos superficiales en los dendrímeros se incrementa exponencialmente con la generación, por lo que se convierte en una interfase entre el dendrímero y su entorno. Asimismo, en contraste con el crecimiento teóricamente infinito de los polímeros lineales, el crecimiento de los dendrímeros está matemáticamente limitado. Durante la síntesis, el número de unidades monoméricas aumenta exponencialmente en cada generación, mientras que el volumen disponible solo crece proporcionalmente al cubo del radio del dendrímero. Cuando se alcanza el punto crítico, el dendrímero ya no puede crecer debido a un impedimento estérico, fenómeno que se conoce como “starburst effect”. En el caso de los dendrímeros PAMAM, el efecto se observa a partir de la G10 (Gupta & Perumal, 2014).
Los dendrímeros de generaciones pequeñas (G 0-3) toman conformaciones asimétricas y abiertas, los de G medias (G 4-6) son estructuras semi-rígidas capaces de albergar moléculas tanto en su interior como unidas a su superficie, mientras que los dendrímeros de G mayores (G 7-10) son esferas rígidas incapaces de aceptar moléculas en su interior y con gran impedimento estérico en su superficie (Caminati, Turro, & Tomalia, 1990; Esfand & Tomalia, 2001; Svenson & Tomalia, 2012). Como se mencionó anteriormente, esto se debe a que a medida que se incrementa la generación del dendrímero, se incrementan proporcionalmente el tamaño, la forma globular, la rigidez de la estructura, la densidad de grupos terminales en la superficie y la densidad de grupos internos (Svenson & Tomalia, 2012). Asimismo, por el método controlado de síntesis, además de las generaciones completas (Gn o Gn.0), también se pueden obtener productos intermedios, que se denominan de generación intermedia (Gn.5) (Suarez et al., 2011).
A partir de su descubrimiento, los dendrímeros emergieron en los múltiples campos de aplicación de la nanotecnología, sobre todo como prometedores nanotransportadores de drogas, debido a sus propiedades controladas, como bajo índice de polidispersidad y selección de los grupos superficiales (Jain et al., 2010; Kolhe, Misra, Kannan, Kannan, & Lieh-Lai, 2003). Si bien se han sintetizado infinidad de tipos de dendrímeros hasta el momento, los más utilizados en la nanomedicina son los dendrímeros PAMAM y los dendrímeros de polipropilenimina (PPI) (Gupta & Perumal, 2014). En esta revisión nos centraremos en los dendrímeros PAMAM con core de etilendiamina de la G4.0, con grupos amino terminales, y de la G4.5, con grupos carboxílicos terminales (Figura 3). Estos son lo más ampliamente utilizados debido a sus óptimas propiedades como nanotransportadores de drogas, pueden incorporar moléculas de fármaco en sus bolsillos internos, o bien anclarlos a sus grupos de superficie mediante interacciones iónicas o covalentes (Markowicz-Piasecka & Mikiciuk-Olasik, 2016). Además, se ha demostrado que estos dendrímeros son capaces de incrementar la solubilidad y estabilidad de las drogas con las que interacionan, aumentando la llegada de las mismas al sitio de acción (M. J. Prieto, Schilrreff, Tesoriero, Morilla, & Romero, 2008; Maria Jimena Prieto et al., 2014; María Jimena Prieto, Temprana, Del Río Zabala, Marotta, & Alonso, 2011).
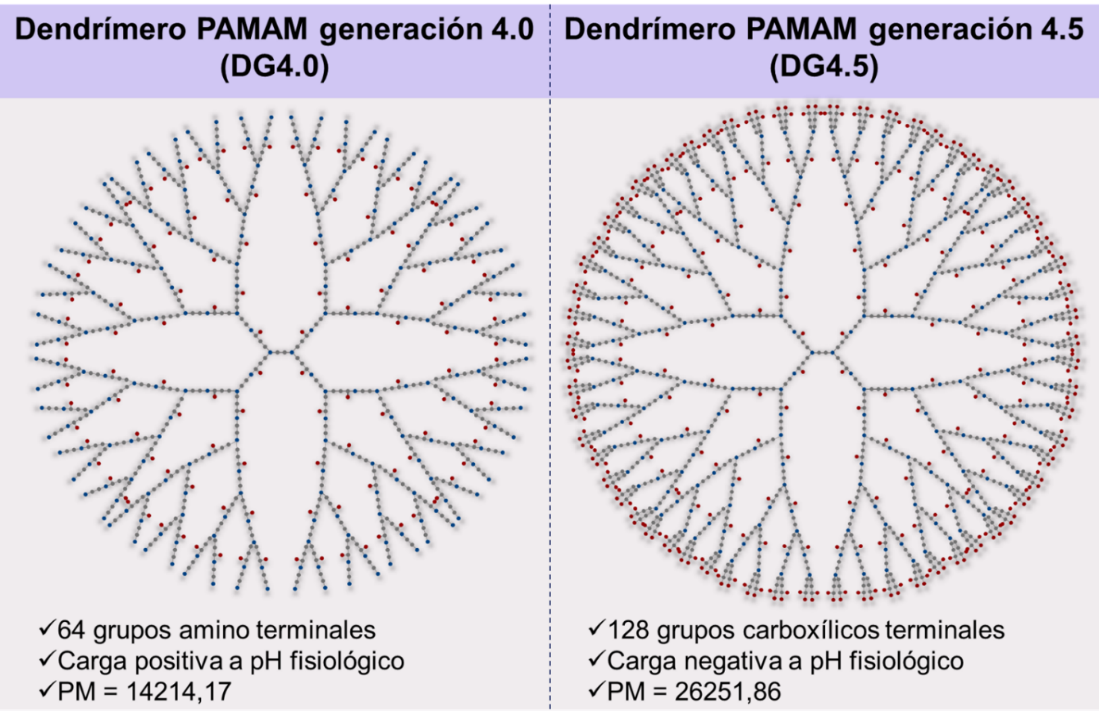
Figura 3 - Representación de los dendrímeros PAMAM generación 4.0 y 4.5.
Cada tipo de átomo se representa con un color (celeste: nitrógeno, rojo: oxígeno, gris: carbono, no se representan los átomos de hidrógeno). Se puede observar el crecimiento radial desde el core de etilendiamina, dando lugar a cadenas con enlaces amidas y ramificaciones con aminas terciarias. Como grupos terminales, los DG4.0 presentan aminas primarias y los DG4.5 ácidos carboxílicos.
La síntesis orgánica de estas macromoléculas permite controlar casi a la perfección los parámetros moleculares como tamaño, forma, química del interior y de la superficie, flexibilidad, topología, entre otros (Maiti, Çaǧin, Wang, & Goddard, 2004), dando lugar a estructuras controladas y monodispersas similares a las observadas en los sistemas biológicos. Inicialmente se describieron dos métodos de síntesis para la obtención de dendrímeros. El grupo de Tomalia y el grupo de Newkome, ambos en 1985, describieron la obtención de dendrímeros por métodos divergentes; mientras que el grupo de Hawker y Fréchet en 1990 describieron un método de síntesis convergente (Hawker & Fréchet, 1990; Newkome et al., 1985; Tomalia et al., 1985). En la actualidad se han desarrollado múltiples métodos de producción de dendrímeros, sin embargo las vías divergentes y convergentes son aún las más utilizadas.
En el método de síntesis divergente (bottom-up), la construcción del dendrímero comienza a partir del core multifuncional, al cual se le unen un número determinado de ramificaciones dependiendo de la valencia del mismo (por ejemplo para un core con dos extremos reactivos se adicionarán cuatro ramas, mientras que para un core de cuatro extremos se adicionaran ocho ramas). En la siguiente etapa, se funcionalizan los extremos de las ramas adicionadas, lo que posibilita la próxima etapa de crecimiento ramificado, dependiente del número de puntos ramificables (Duncan & Izzo, 2005). Luego, se unen nuevas ramas cuyos extremos se funcionalizan y así continua progresivamente hasta alcanzar la generación deseada (Figura 4). Es decir que para dar lugar a cada una de las generaciones, se realizan dos reacciones consecutivas; en la primera se adicionan las ramas y en la siguiente se funcionalizan los extremos. Las limitaciones de este método de síntesis incluyen que se debe utilizar un exceso de monómero en cada reacción y se requieren extensas separaciones cromatográficas para purificar las distintas generaciones de dendrímeros.
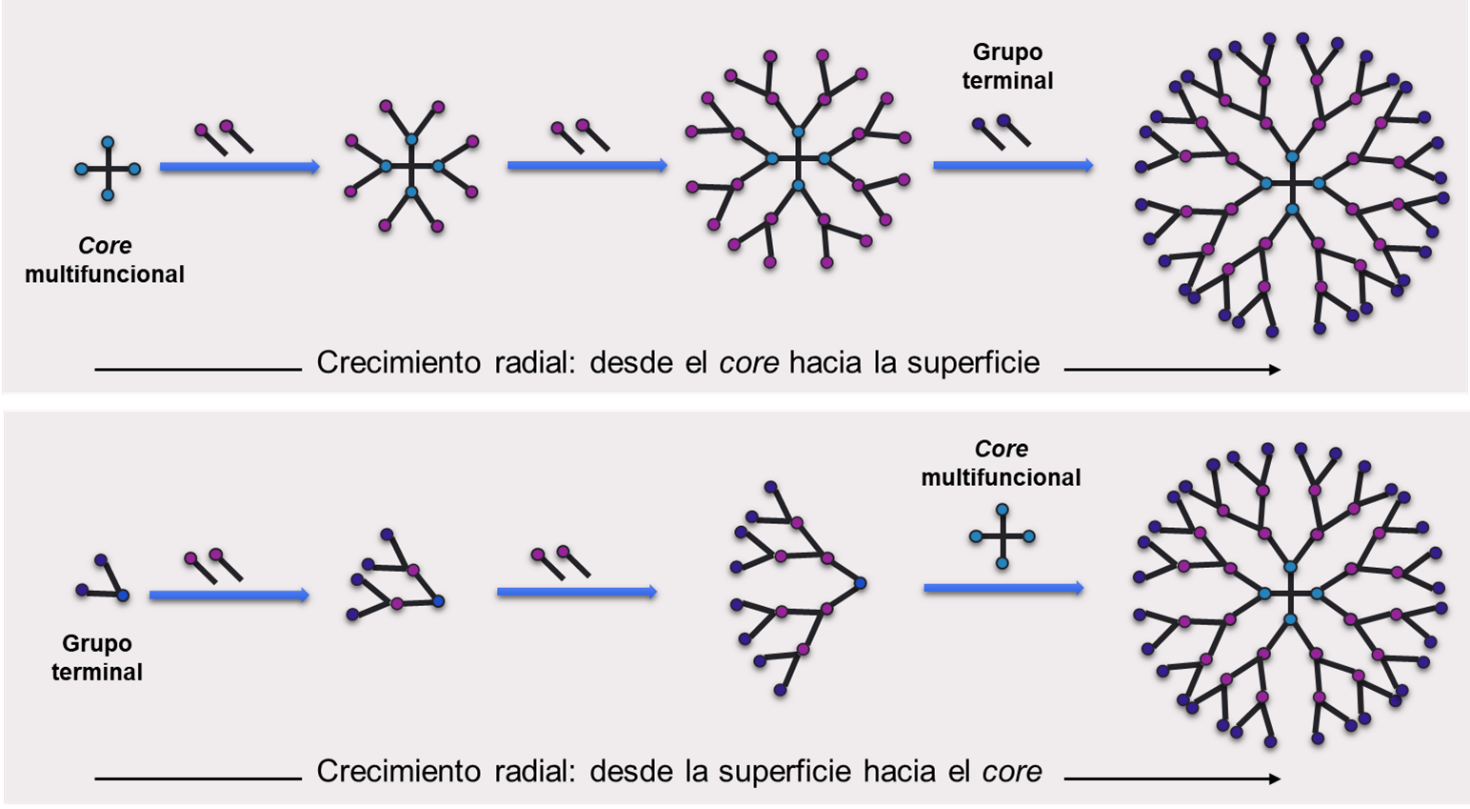
Figura 4 – Método divergente de síntesis de dendrímeros.
El crecimiento ocurre radialmente desde el core hacia la superficie, por adición progresiva de ramas y puntos de ramificación.
Particularmente, la síntesis divergente de los dendrímeros PAMAM comienza a partir del core de etilendiamina, que posee dos extremos ramificables amina primaria. Al mismo se adicionan, en dos reacciones sucesivas, capas de metacrilato y de etilendiamina, lo que da lugar a cadenas de carbono con enlaces amidas internos y a extremos de amina primaria. Estos extremos con grupos aminos actúan como puntos de ramificación para la adición de otras capas de metacrilato y etilendiamina, lo que da lugar a la formación de aminas terciarias internas (Figura 5). Dichas aminas terciarias en el interior del dendrímero son los puntos de ramificación a partir de los cuales crece la estructura, generación tras generación (Suarez et al., 2011; Svenson & Tomalia, 2012). En las generaciones intermedias de los dendrímeros PAMAM, como es el caso del DG4.5, a partir del DG4.0 solo se adiciona una capa de metacrilato, que se modifica para dejar expuestos ácidos carboxílicos terminales.
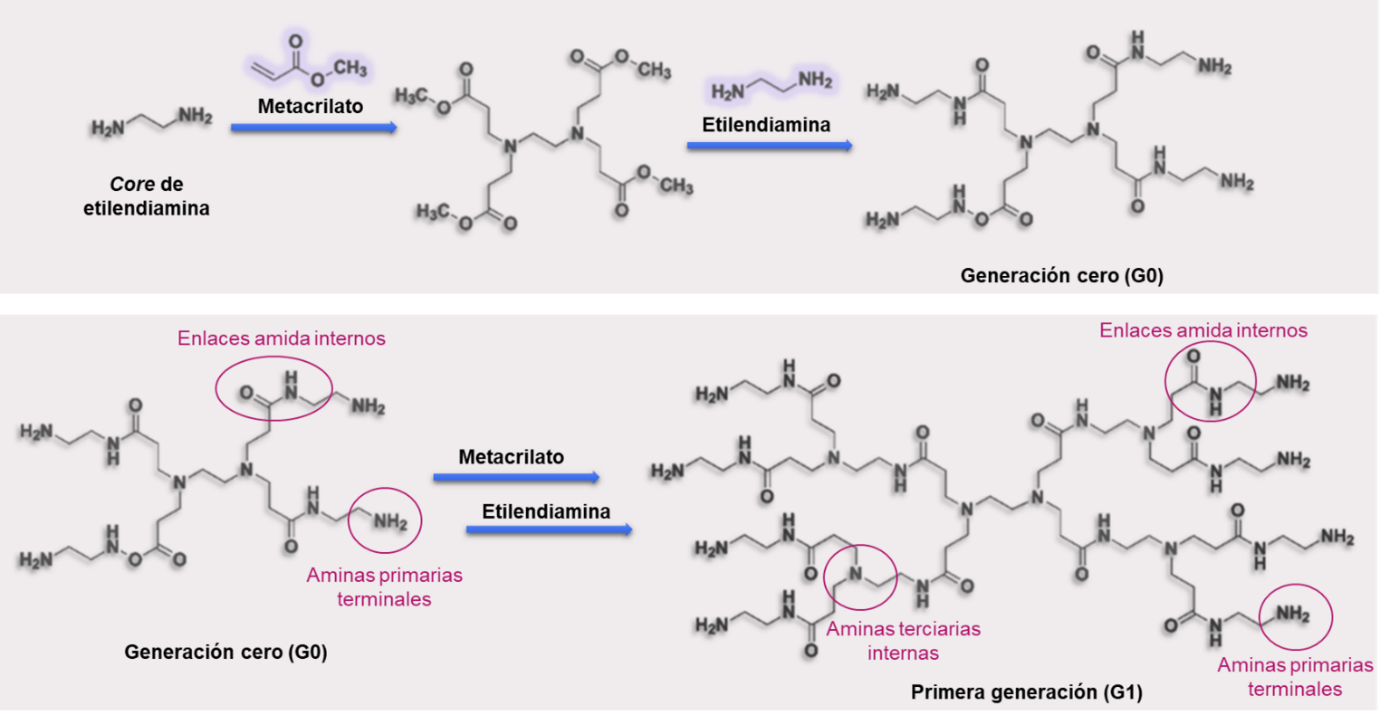
Figura 5 – Síntesis divergente de dendrímeros PAMAM con core de etilendiamina (Starburst®).
A partir del core de etilendiamina se adicionan, en reacciones sucesivas, capas de metacrilato y etilendiamina. Se obtienen dendrímeros con enlaces amida y amina terciaria internos (de allí el nombre poliamidoamina).
Por otro lado, en el método de síntesis convergente, la construcción comienza generando unidades ramificadas llamadas dendrones, que se unen en un último paso al core multifuncional para dar lugar a los dendrímeros (Duncan & Izzo, 2005). El crecimiento de los dendrones comienza desde los grupos terminales hacia el interior, contrariamente a lo que ocurre en el método divergente. Sin embargo, al igual que en el otro método, el crecimiento de cada generación implica dos pasos de reacción consecutivos; en este caso, primero se funcionalizan los grupos terminales para que sean ramificables, y luego se los unen para formar las ramificaciones (Figura 6). La ventaja de este método es que se obtienen dendrímeros con menos errores, dado que se seleccionan y utilizan solo los dendrones correctamente formados para la unión al core. Sin embargo, está limitado a la producción de generaciones pequeñas debido a los inconvenientes estéricos a nanoescala que se presentan cuando se unen dendrones de gran tamaño a un único core central.
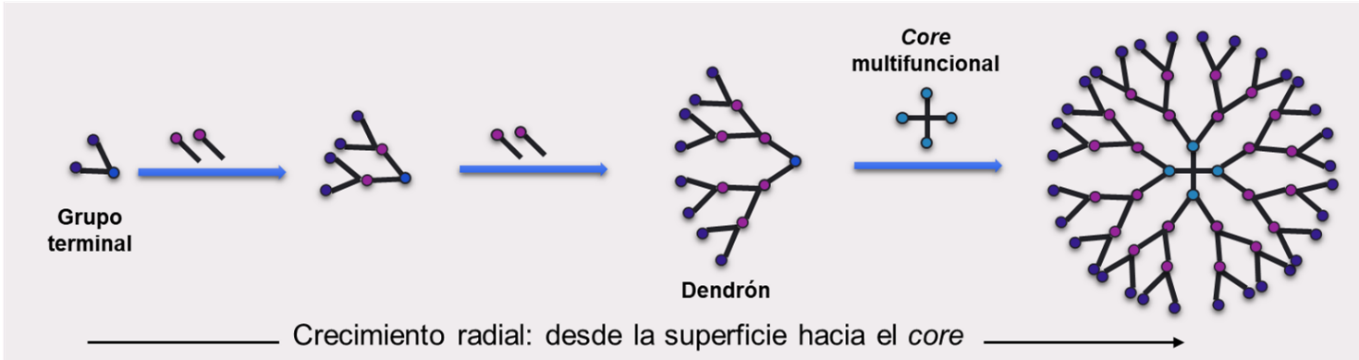
Figura 6 – Método convergente de síntesis de dendrímeros.
El crecimiento ocurre radialmente desde el la superficie hacia el interior de los dendrones, que luego se unen a un core multifuncional.
Uno de los principales desafíos para el uso y aplicación de los dendrímeros es la simplificación de sus métodos de síntesis. En la actualidad, el objetivo es aumentar las cantidades producidas para su comercialización masiva y, además, para disminuir los costos de producción. En la búsqueda de nuevos métodos de síntesis, se han combinado las estrategias divergentes y convergentes, se han implementado estrategias de auto-ensamblaje, y se han desarrollado técnicas completamente novedosas (Kesharwani, Jain, & Jain, 2014). Sowinska y col. (2014) realizaron una revisión al respecto, en donde se profundizan los métodos conocidos como hipercore, hipermonómeros, doble exponencial, ortogonal, click y lego (Sowinska & Urbanczyk-Lipkowska, 2014).
La arquitectura de los polímeros macromoleculares se podía clasificar en lineal, entrecruzada o ramificada. A partir de la síntesis de los dendrímeros, la arquitectura dendrítica se ha desplegado como la cuarta familia de arquitecturas macromoleculares (Figura 7). Dentro de la arquitectura dendrítica se incluyen a los polímeros hiperramificados, a los dendrigrafts, a los dendrones y a los dendrímeros (Kesharwani et al., 2014).
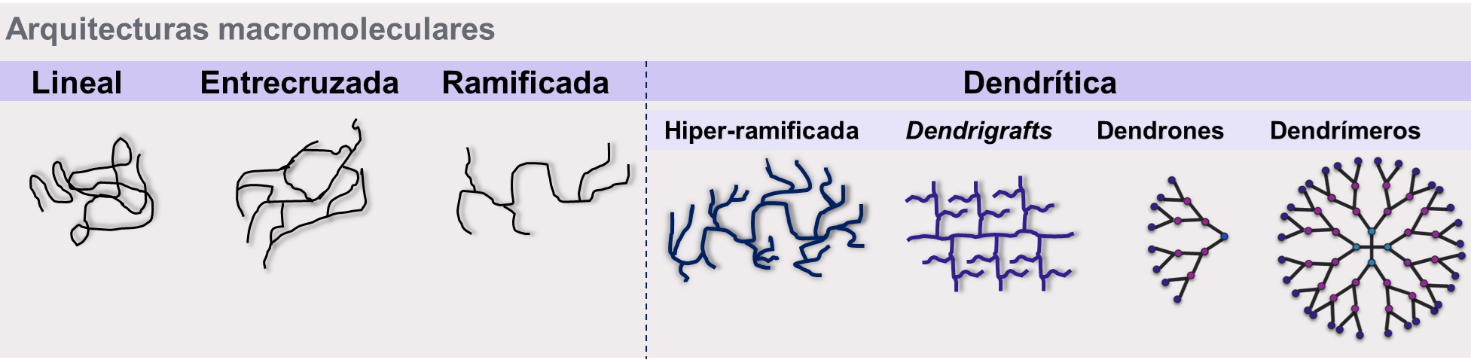
Figura 7 – Representación de las arquitecturas macromoleculares.
Los polímeros pueden ser clasificados en lineales, entrecruzados, ramificados o dendríticos.
La arquitectura dendrítica es una de las topologías biológicas más conservada, dado que puede ser encontrada en los sistemas biológicos en todas las escalas de tamaño. Por ejemplo, esta arquitectura se puede encontrar en la escala del metro, en las ramas de los árboles o en sus raíces; en la escala de los centímetros y milímetros en las topologías de la circulación del cuerpo humano, sobre todo en los pulmones, el hígado y el riñón; o en la escala de los micrómetros en las neuronas y sus dendritas. También se puede encontrar en la escala del nanómetro a nivel molecular, por ejemplo en la estructura del glucógeno, la amilopectina y los proteoglicanos. La existencia de estos patrones dendríticos en diferentes escalas biológicas deja en evidencia que las estructuras altamente ramificadas ofrecen ventajas únicas a nivel funcional.
Particularmente, la arquitectura de los dendrímeros tiene tres dominios distinguibles: el core iniciador, las capas interiores (generaciones) compuestas por unidades que se adicionan radial y ramificadamente desde el core, y los grupos funcionales terminales que forman la superficie del dendrímero (Fréchet & Tomalia, 2003; Gupta & Perumal, 2014; Jain et al., 2010).
El core es una molécula multifuncional que actúa como núcleo de la arquitectura del dendrímero. Estas moléculas se caracterizan por tener grupos reactivos que funcionan como puntos de ramificación iniciales a partir de los cuales se despliega la estructura dendrítica. Se pueden clasificar en bi-, tri-, y tetra-funcionales, según presenten dos, tres o cuatro grupos ramificables, respectivamente (Figura 8). Para la producción de dendrímeros se han utilizado distintos tipos de core, siendo los reactivos bifuncionales más utilizados la etilendiamina (EDA) y butilendiamina (DAB, por diaminobutano); de los trifuncionales, el amoniaco y la triazina; y de los tetrafuncionales, el clorato de tiofosforilo (TC) y el tetrametilsilano (Gupta & Perumal, 2014). Dentro de una misma familia, el tipo de core modificará las propiedades del dendrímero. Por ejemplo, la longitud de core puede afectar la capacidad de encapsular moléculas, debido a que modificará la densidad del empaquetamiento de las generaciones que crecen a partir de él (Svenson & Tomalia, 2012). Del mismo modo, la funcionalidad del core determinará la cantidad de ramificaciones y de grupos terminales para una misma generación de dendrímero.
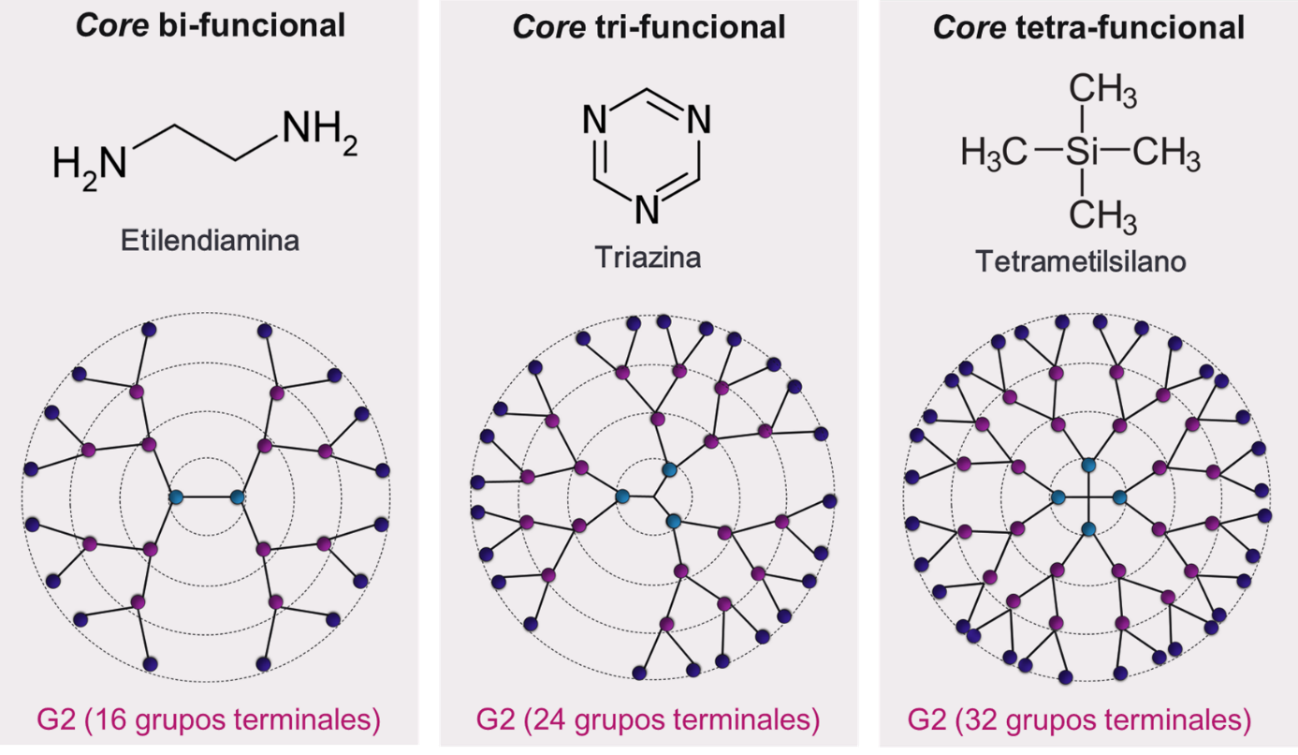
Figura 8 – Clasificación de los core según cantidad de grupos funcionales.
Se presentan tres moléculas ejemplo de cada tipo de core, y se muestra como la funcionalidad del core afecta a la densidad de ramificaciones y a la cantidad de grupos terminales para una misma G de dendrímeros.
Las capas repetitivas que se presentan radial y ramificadamente desde el core iniciador se llaman generaciones. Las características químicas (tipo de átomos y enlaces) que dan lugar a estas ramificaciones son las que determinan el tipo de dendrímero o la nomenclatura general que se le atribuye a esa familia de polímeros. Por ejemplo, cuando estas ramificaciones son grupos de poliamidoamina, los dendrímeros de conocen como PAMAM, independientemente de la molécula que forme el core. Como se mencionó, se han sintetizado diversos tipos de dendrímeros, pero los más estudiados son los dendrímeros PAMAM, PPI, de poli-L-lisina (PLL), de poliéster, de poliglicerol, de triazina, los fosfodendrímeros y los glicodendrímeros (Figura 9) (de la Torre, 2018; Markowicz-Piasecka & Mikiciuk-Olasik, 2016).
Finalmente, en la superficie de los dendrímeros se encuentran los grupos terminales, cuyas características químicas, junto con las del core y las ramificaciones, terminarán de determinar las propiedades particulares de cada dendrímero. Por ejemplo, estos grupos superficiales son los que determinan la solubilidad de los dendrímeros y su carga en distintas condiciones de pH (Markowicz-Piasecka & Mikiciuk-Olasik, 2016). Debido al método controlado de síntesis, una misma familia de dendrímeros puede obtenerse con distintos grupos terminales. En general, los grupos más utilizados son aldehído, alcohol, amina primaria, ácido carboxílico, ácido succínico y aminoetanol (Figura 10), lo que permite clasificar a los dendrímeros en aniónicos, catiónicos o neutros a pH fisiológico (Gupta & Perumal, 2014).
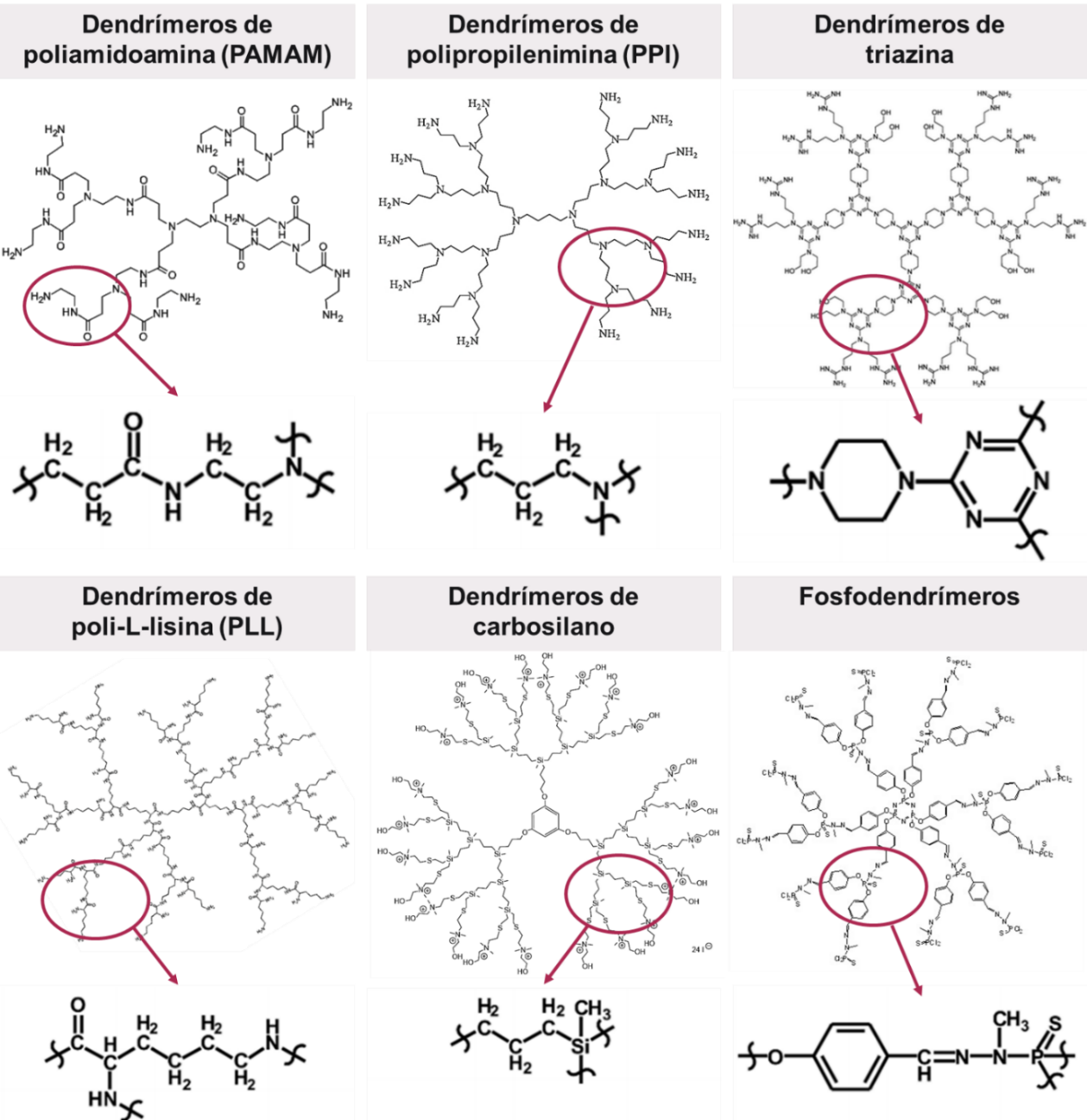
Figura 9 – Clasificación del tipo de dendrímero según sus ramificaciones.
Se presentan algunos ejemplos de dendrímeros y la estructura química de sus ramificaciones.
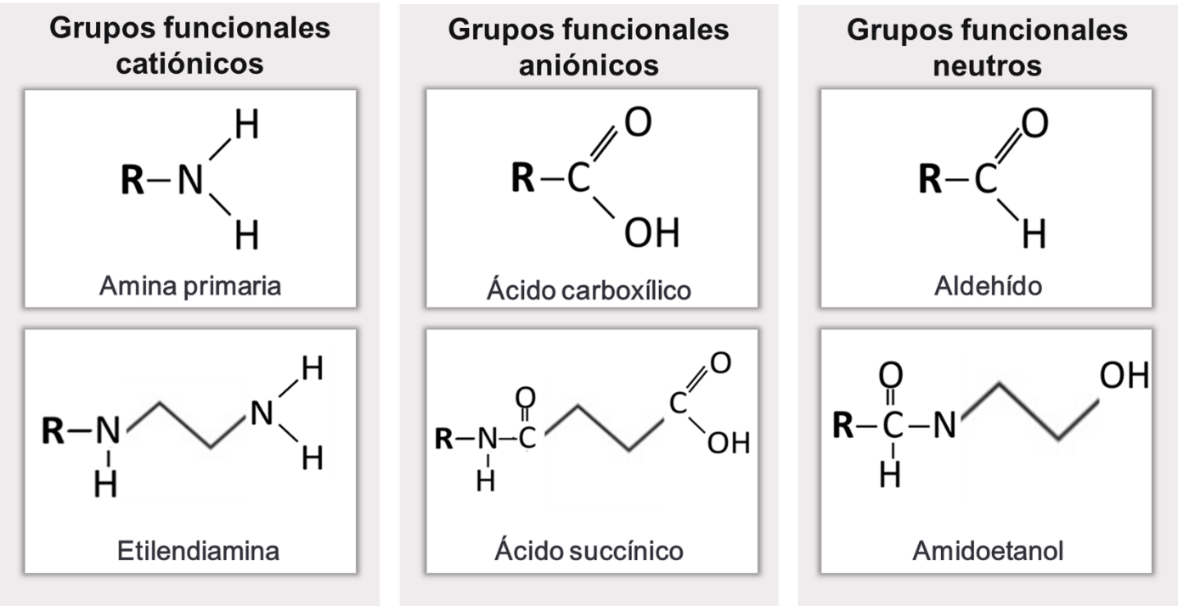
Figura 10 – Clasificación de los dendrímeros según sus grupos funcionales terminales.
Se presentan ejemplos de grupos terminales que dan lugar a dendrímeros catiónicos, aniónicos o neutros a pH fisiológico.
Modificando los tres dominios de la arquitectura de los dendrímeros (core, ramificaciones y grupos terminales), se pueden diseñar y sintetizar dendrímeros para propósitos específicos, como dendrímeros con propiedades anti-virales o anti-bacterianas, o dendrímeros para transportar drogas a sitios particulares. La modificación de los grupos superficiales permite tanto seleccionar las características de carga y funcionalidad del dendrímero, como la adición de moléculas de reconocimiento o de moléculas bioactivas (drogas); mientras que la modificación de la generación permite determinar la proximidad entre los grupos superficiales y la conformación del dendrímero.
Las características únicas de esta clase de nanomateriales permiten su aplicación en múltiples y diversos campos del conocimiento, como la biomedicina, la química, las ciencias biológicas, la ciencia de los materiales, la ingeniería y la electrónica (Jain et al., 2010). Por ejemplo, en el área de la electrónica, los dendrímeros se han utilizado para diseñar sensores ópticos, displays y dispositivos de recolección de luz (D’Emanuele & Attwood, 2005).
Particularmente en el campo de la nanomedicina, las características determinantes de la utilización de los dendrímeros son: arquitectura simétrica, estable y bien definida; tamaño monodisperso y controlado en el rango de los nanómetros; estructura ramificada multivalente y multifuncional; grupos superficiales de tipo, carga y cantidad controlada; relación área/volumen extremadamente alta; rran reactividad química y solubilidad en agua; no modifican significativamente la viscosidad de la suspensión, en comparación con los polímeros lineales del mismo peso molecular; tienen estructura multifuncional que permite la interacción cooperativa de varias sustancias a la vez (o de una sustancia y membranas biológicas); tienen bolsillos internos permite su utilización como encapsuladores de moléculas; entre otras características (Kesharwani et al., 2014; Donald A. Tomalia, Naylor, & Goddard, 1990).
Dichas características dieron lugar a la aplicación de los dendrímeros como: nanotransportadores de drogas; sistemas de delivery de genes (terapia génica in vivo y transfección in vitro); aditivos en la industria farmacéutica (como adyuvantes en vacunas) y cosmética (como potenciadores de la penetración en sistemas tópicos); agentes de contraste (imágenes medicinales y diagnóstico temprano); agente fotodinámicos (terapia fotodinámica y fototérmica); agentes con acción catalítica; y agentes en inmunoensayos (Ammala, 2013; Menjoge, Kannan, & Tomalia, 2010; Qiao & Shi, 2015; Reek, Arévalo, van Heerbeek, Kamer, & van Leeuwen, 2006; Yang, Zhang, Chang, & Cheng, 2015)
Muchas veces se han referido a los dendrímeros como proteínas artificiales, debido a sus dimensiones nanométricas, monodispersidad y otras propiedades biomiméticas (Sheikhpour, Barani, & Kasaeian, 2017). Estas propiedades de los dendrímeros han llevado a que los mismos sean utilizados como reemplazo de proteínas en técnicas de inmunodiagnóstico y aplicaciones de expresión genética in vitro (Esfand & Tomalia, 2001). Sobre todo los dendrímeros PAMAM están estrechamente emparentados en tamaño y forma con muchas proteínas globulares importantes (Figura 11); por ejemplo los dendrímeros PAMAM G3.0, G4.0 y G5.0 son de aproximadamente el mismo tamaño y forma que la insulina (3 nm), el citocromo C (4 nm) y la hemoglobina (5,5 nm), respectivamente. Del mismo modo, los dendrímeros G5.0 y G6.0 tienen diámetros equivalentes a la bicapa lipídica de las membranas biológicas. Por otro lado, los dendrímeros PAMAM G7.0 a G10.0 presentan forma y tamaño similar a las histonas, proteínas capaces de formar complejos estables con el DNA, lo que explica la extraordinaria estabilidad de los complejos DNA-PAMAM y su utilización como sistemas de delivery génico (Eichman, Bielinska, Kukowska-Latallo, & Baker, 2000; Esfand & Tomalia, 2001; Svenson & Tomalia, 2012).
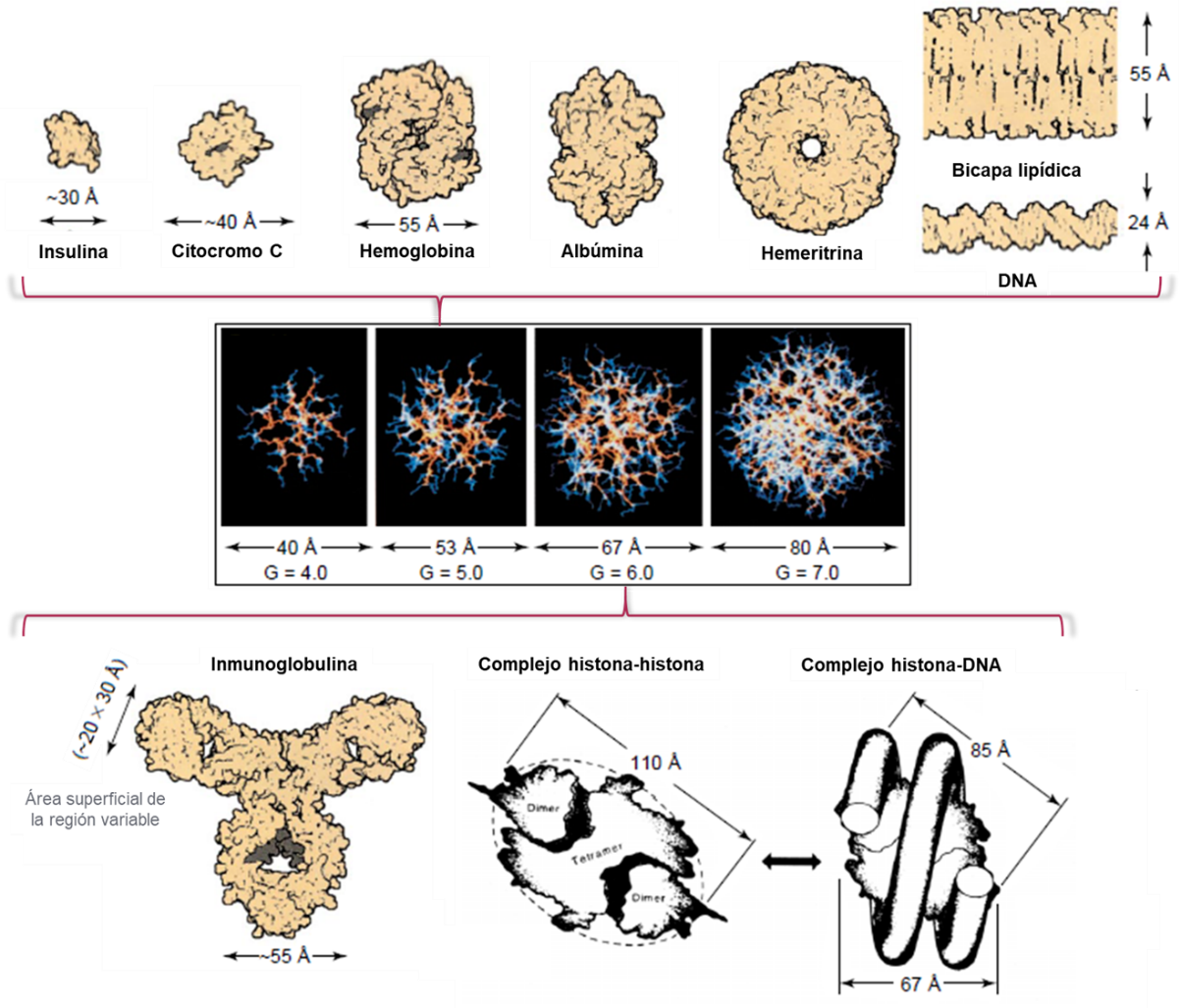
Figura 11 – Comparación del tamaño de los dendrímeros PAMAM con proteínas globulares y otros componentes celulares.
Modificada de (Esfand & Tomalia, 2001).
Además de por su tamaño, las características químicas de las ramificaciones de los dendrímeros PAMAM permitirían considerarlos como derivados oligoméricos del aminoácido β-alanina (Buczkowski, Olesinski, Zbicinska, Urbaniak, & Palecz, 2015). Si bien existen muchas similitudes, es importante resaltar las diferencias. Las proteínas globulares son estructuras terciarias resultado del plegado de estructuras lineales, que tienen, en general, interiores densamente empaquetados y superficies con dominios de funcionalidad y polaridad diferencias (algunas zonas hidrofóbicas y otras hidrofílicas). Por su parte, los dendrímeros presentan formas globulares debido a su estructura ramificada, pero su interior suele no estar densamente empaquetado sino que posee bolsillos internos acuosos y su superficie es homogénea con propiedades definidas por el tipo de grupo terminal (Svenson & Tomalia, 2012).
Un área de gran interés es el estudio de la interacción entre drogas y dendrímeros (D’Emanuele & Attwood, 2005). Particularmente, los dendrímeros han demostrado incrementar la solubilidad, estabilidad y biodisponibilidad de las drogas con las que interaccionan (Jain et al., 2010). Asimismo, modifican el perfil de liberación de las drogas, por ello se han convertido en una plataforma interesante para el desarrollo de sistemas de delivery. Los dendrímeros aportan propiedades únicas a este campo, ya que tienen características relevantes como polidispersidad mínima, estructura de superficie definida, elevada solubilidad en agua y tamaño muy pequeño y controlado en el rango de nanómetros (Kalomiraki, Thermos, & Chaniotakis, 2015; Kesharwani et al., 2014; Svenson & Tomalia, 2012; Donald A. Tomalia et al., 1990). El perfecto sistema de nanotransporte de drogas basado en dendrímeros debería aumentar la solubilidad de la droga en agua (con una elevada capacidad de carga), aumentar la estabilidad de la droga en el tiempo, presentar baja o nula toxicidad, ser biodegradable, presentar características favorables de retención y biodistribución en el organismo, y no ser inmunogénico (Markowicz-Piasecka & Mikiciuk-Olasik, 2016).
Los mecanismos por los cuales los dendrímeros pueden solubilizar las drogas, estabilizarlas y actuar como nanotransportadores se han clasificado (Figura 12) como:
*Conjugación: la interacción dendrímero-droga está mediada por enlaces covalentes entre la droga y la superficie y/o el interior de los dendrímeros. Los conjugados dendrímero-droga se obtienen por reacción química, por lo que sus características dependerán del método de conjugación. La unión de la droga puede ocurrir directamente al dendrímero o a través de una molécula que actúa como linker
*Complejación: la interacción dendrímero-droga es de tipo no covalentes, pudiendo involucrar interacciones electrostáticas, de puente de hidrógeno, hidrofóbicas o de van der Waals. En los complejos dendrímero-droga el tipo de interacción establecida dependerá de las características del dendrímero (generación y tipo de core, de ramificaciones y de grupos superficiales), de las características de la droga y de las condiciones fisicoquímicas del medio (pH, temperatura, fuerza iónica, tipo de solvente, entre otras).
Se han diferenciado dos tipos de mecanismos de complejación dependiendo del sitio donde ocurra la interacción, según:
**Encapsulación dentro de la arquitectura del dendrímero: las drogas se incorporan en los bolsillos internos de los dendrímeros.
**Anclaje en la superficie de los dendrímeros: las drogas interaccionan con los grupos terminales de los dendrímeros.
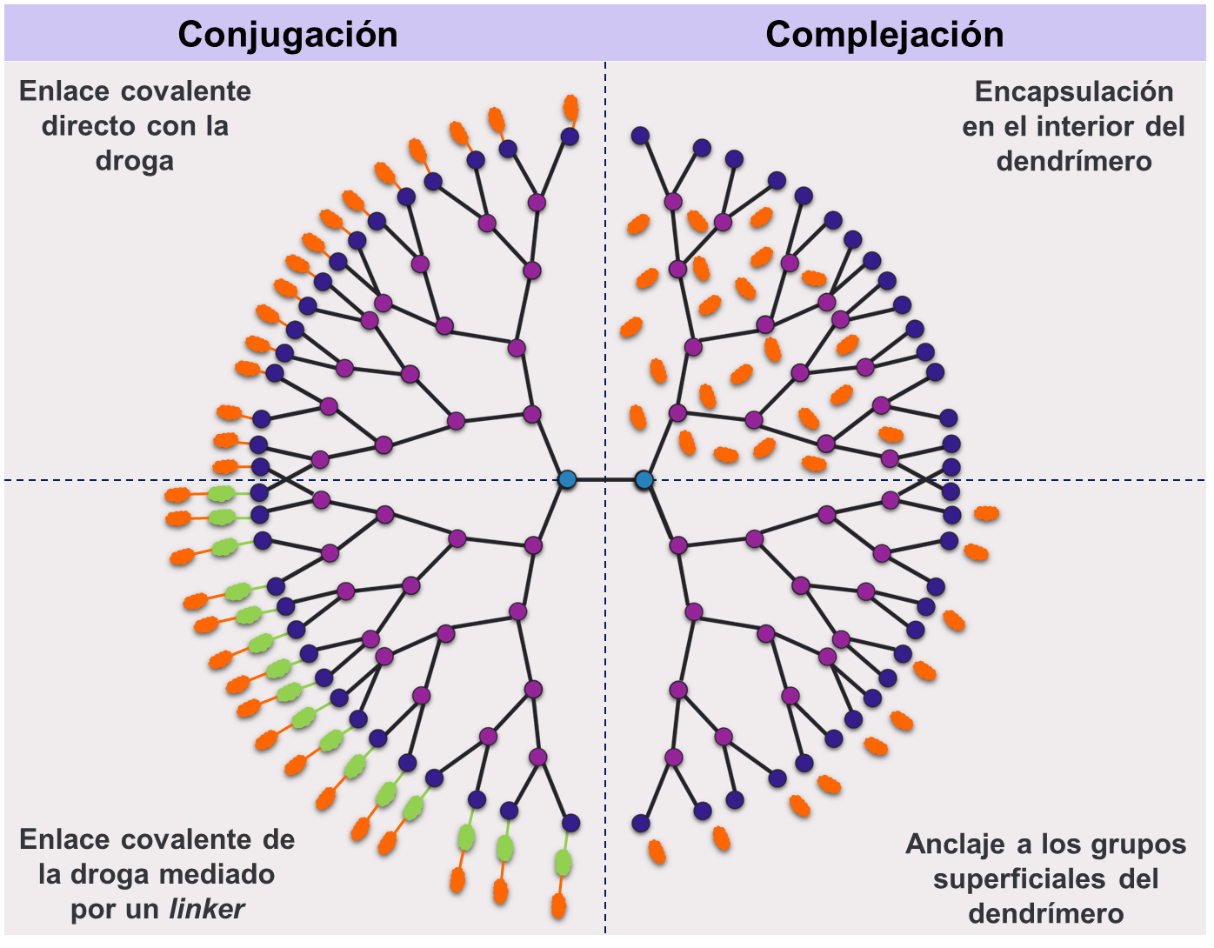
Figura 12 – Mecanismos de interacción entre drogas y dendrímeros.
Los mecanismos se dividen en conjugación (mediados por enlaces covalentes) y complejación (mediados por interacciones no covalentes) dentro de los bolsillos internos y/o en la superficie del dendrímero.
La superficie de los dendrímeros brinda una gran cantidad de grupos funcionales para la unión covalente de las moléculas de droga de interés y, además, de otra variedad de ligandos específicos. Asimismo, los grupos internos de los dendrímeros pueden actuar como sitios de conjugación, pero las reacciones químicas necesarias son más complejas que para modificar los grupos superficiales expuestos.
La unión covalente al dendrímero se puede realizar directamente a su estructura, o se puede establecer a través de linkers con propiedades particulares. Por ejemplo, linkers biodegradables o linkers hidrolizables en el sitio-específico de acción, lo que ofrece la oportunidad de mejorar el perfil de liberación de las drogas (D’Emanuele & Attwood, 2005; Najlah & D’Emanuele, 2007).
Los dendrímeros PAMAM se han utilizado para generar conjugados con diversas moléculas de drogas, entre ellas: ibuprofeno, propranolol, metotrexato, dexametasona, paclitaxel, cisplatino, penicilina y venlafaxina (Gupta & Perumal, 2014; Hsu, Bugno, Lee, & Hong, 2017; Kalomiraki et al., 2015). En estos trabajos se reflejan las potencialidades del uso de conjugados dendrímero-droga para aumentar la solubilidad en agua y la estabilidad química de las moléculas de droga.
Además, los dendrímeros PAMAM se han modificado con una multiplicidad de otras moléculas, tales como ligandos de receptores de membrana celular, modificadores de la solubilidad, moléculas que reducen la interacción con macromoléculas del sistemas inmunológico y marcados radiactivos, entre otras. La molécula más utilizada en bibliografía para modificar la superficie de los dendrímeros es el ácido fólico, debido a que los receptores de folato se sobreexpresan en la membrana plasmática de las células cancerígenas; por lo tanto, se espera que los dendrímeros modificados con folato funcionen como delivery selectivo de drogas al interior de las células tumorales (Quintana et al., 2002). Por otro lado, los hidratos de carbono constituyen otra clase importante de moléculas de reconocimiento biológico que se han utilizado para modificar la superficie de los dendrímeros. Específicamente, para que la unión entre los oligosacáridos y sus receptores de membrana pueda concertarse, los ligandos deben estar presentes formando clústeres, por lo tanto la superficie de los dendrímeros podría funcionar como plataforma óptima para tales presentaciones (Lundquist & Toone, 2002). Por ejemplo, se han utilizado multiplicidad de glicodendrímeros como agentes de diagnóstico o en la generación de vacunas (Bezouška, 2002).
La complejación de drogas en los dendrímeros puede ocurrir por dos mecanismos: encapsulación en sus bolsillos internos y/o anclaje en sus grupos superficiales.
La encapsulación involucra interacciones no covalentes con la estructura interna de los dendrímeros; mientras que el anclaje requiere de la interacción no covalente con los grupos superficiales (D’Emanuele & Attwood, 2005). Los factores que modifican la capacidad de los dendrímeros para actuar como complejadores de drogas incluyen cuestiones relacionadas con el dendrímero en sí (generación, naturaleza de la superficie del dendrímero, de las ramificaciones y del core, y concentración) o con el medio (pH de la solución, naturaleza del solvente, presencia de sales y temperatura) (Choudhary, Gupta, Rani, Dave, & Gupta, 2017).
En primer lugar, la capacidad de encapsulación de moléculas en el interior dependerá de la generación del dendrímero. Como se mencionó anteriormente, las generaciones pequeñas (
En segundo lugar, la presencia de cavidades internas está íntimamente relacionada con el estado conformacional del dendrímero, lo que depende de las condiciones del medio (como pH, fuerza iónica y tipo solvente) y las características químicas del dendrímero (pKa de sus grupos funcionales, hidrofobicidad de los bolsillos, impedimentos estéricos de la superficie y rigidez de sus ramificaciones). Se ha descripto que, dependiendo de las condiciones en que se encuentran, los dendrímeros podrían adoptar diferentes conformaciones que producirían cambios en el empaquetamiento de sus grupos internos y terminales. Por ejemplo, los dendrímeros PAMAM de generación completa (como los DG4.0) exhiben conformaciones abiertas a bajo pH debido a la repulsión electrostática entre las aminas terciarias internas y las aminas primarias externas, ambas protonadas, lo que rigidiza las ramas del dendrímero y las fuerza a alejarse del interior. Por otro lado, a pH básico, las ramas se retraen como consecuencia de los puentes de hidrógeno entre las aminas terciarias del interior y las aminas primarias de la superficie, ambas desprotonadas, proceso que se conoce como back-folding y resulta en una estructura compacta (Figura 13) (W. Chen, Tomalia, & Thomas, 2000). En concordancia con el estado de protonación, se ha demostrado que el agua tiene capacidad para ingresar a los dendrímeros y dicha capacidad es dependiente del pH (Suarez et al., 2011). Estos cambios conformacionales relacionados con el pH dependen del pKa de los grupos terminales y de los grupos del interior del dendrímero. Por ello, los dendrímeros PAMAM de generaciones intermedias (como los DG4.5 con grupos carboxílicos terminales), muestran conformaciones abiertas tanto a pH ácido como básico, pero una estructura más compacta a pH fisiológico.
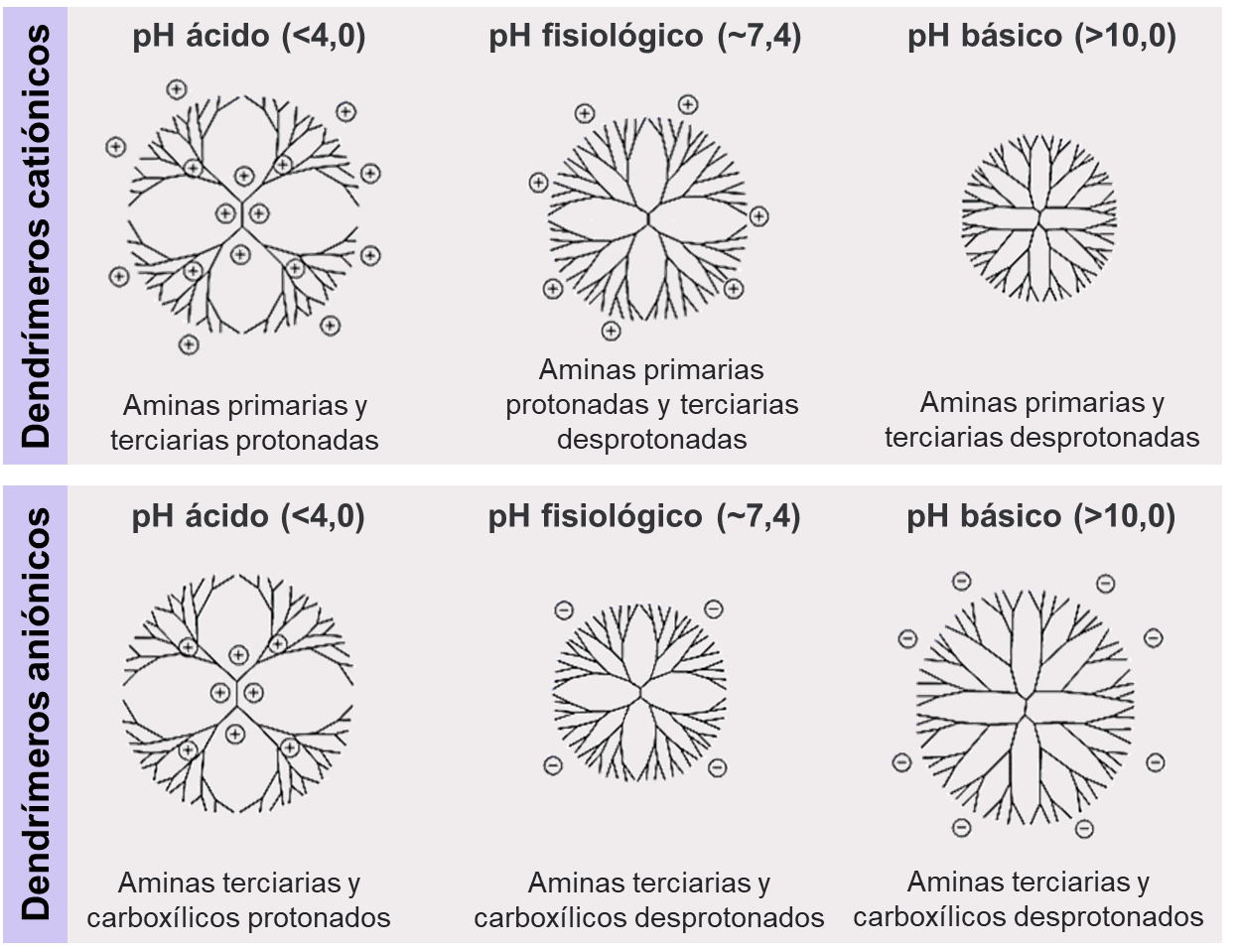
Figura 13 – Conformación estructural de los dendrímeros PAMAM en función del pH.
El estado de protonación de los grupos funcionales internos y terminales depende del pH. La conformación de los dendrímeros depende del estado de protonación de dichos grupos.
En tercer lugar, la polaridad y la pureza del solvente afecta la conformación de los dendrímeros debido al proceso de back-folding de los grupos terminales (Maiti, Çaǧin, Lin, & Goddard, 2005). Particularmente, a una menor capacidad de solvatación del medio, mayor back-folding de los dendrímeros. En estudios de resonancia magnética nuclear se observó que dendrímeros polares en solventes no polares tienen mayores interacciones intra- e inter-moleculares, lo que resulta en un interior compacto y en la agregación de los dendrímeros (Suarez et al., 2011), mientras que en solventes polares tienen una estructura abierta. Estos cambios conformacionales dependiendo del solvente serán inversos en el caso de dendrímeros no polares.
En cuarto lugar, los dendrímeros pueden modificar la solubilización de las drogas de manera concentración-dependiente; se ha demostrado que al aumentar la concentración de dendrímero se incrementa la concentración de droga de manera lineal (Chauhan et al., 2003; Ke, Zhao, Huang, Jiang, & Pei, 2008; J. Patel, Basu, Dharamsi, Garala, & Raval, 2011).
Si bien el número de moléculas de drogas que se pueden encapsular en los dendrímeros está restringida por el tamaño y conformación de los bolsillos internos, la capacidad de carga se ve drásticamente incrementada si se pueden formar complejos por interacción con los grupos superficiales de los dendrímeros. Por ejemplo, los dendrímeros PAMAM G4.0 con core de EDA tienen 64 grupos amina primaria terminales con carga positiva a pH fisiológico, que podrían interactuar con moléculas de drogas que presenten carga negativa en dichas condiciones; mientras que los dendrímeros PAMAM G4.5 con core de EDA tienen 128 grupos carboxílicos terminales con carga negativa a pH fisiológico, que podrían interactuar con moléculas de droga que presenten carga positiva. Obviamente, las interacciones electrostáticas establecidas entre los grupos terminales de los dendrímeros y las moléculas de droga dependerán del pH del medio y del pKa de los grupos ionizables.
Gracias a sus propiedades como complejadores de drogas, los dendrímeros en general han sido utilizados como solubilizadores y estabilizadores de bioactivos con diferentes enfoques terapéuticos, por ejemplo como nanotransportadores de compuestos anti-cáncer, anti-malaria, anti-virales, anti-tuberculosis, anti-microbianos, anti-inflamatorios, anti-hipertensivos, entre otros (Kesharwani et al., 2014). En particular, los dendrímeros PAMAM se han utilizado para complejar diversas moléculas de drogas, entre ellas: indometacina, metotrexato, doxorubicina, ibuprofeno, SN-38, 5-fluorouracilo, nadifloxacina, nitrato de pilocarpina, flurbiprofeno, naproxeno, indometacina, ketoprofeno, piroxicam, tamsulosina, aceclofenaco, amfotericina B, haloperidol y risperidona (Choudhary et al., 2017; Gupta & Perumal, 2014; Mohanty, Das, & Sahoo, 2012). En estos trabajos se resalta la capacidad de los dendrímeros de complejar drogas, aumentando su solubilidad y su estabilidad en medios acuosos, sin la necesidad de reacciones químicas entre la droga y el nanotransportador que podrían modificar las propiedades particulares de cada uno.
Los dendrímeros han sido estudiados como nanodrogas per se, debido a sus propiedades anti-bacterianas, anti-priones, anti-virales, anti-coagulantes, anti-oxidantes, anti-inflamatorias, y anti-agregación de proteínas, entre otras. Estas propiedades se han estudiado y revisado extensamente (Kalomiraki et al., 2015; Mignani et al., 2017; Nance et al., 2016; Sepúlveda-Crespo, Ceña-Díez, Jiménez, & Ángeles Muñoz-Fernández, 2017).
Los dendrímeros anti-bacterianos poseen, en general, grupos catiónicos en su superficie, como grupos aminas o tetralquilamonio. Esta carga positiva les permite interactuar con las membranas bacterianas aniónica y dañarla, causando la lisis bacteriana (Boas & Heegaard, 2004; C. Z. Chen & Cooper, 2002). Por ejemplo, los dendrímeros PPI con grupos tetralquilamonio en la superficie han demostrado ser potentes agentes anti-bacterianos contra bacterias Gram-positivas y Gram-negativas (C. Z. Chen et al., 2000), mientras los dendrímeros PLL con grupos manosil superficiales fueron eficientes inhibidores del crecimiento de E. Coli (Nagahori et al., 2002). Por otro lado, Calabretta y col. (2007) demostraron que los dendrímeros PAMAM G5.0 fueron tóxicos contra P. aeruginosa y S. aureus de manera concentración dependiente (Calabretta, Kumar, McDermott, & Cai, 2007). Recientemente, Holmes y col. (2019) observaron que mientras los dendrímeros PAMAM catiónicos presentaron efectos anti-microbianos generación-dependiente, los dendrímeros PAMAM aniónicos no actuaron como anti-microbianos, presumiblemente debido a que no interaccionan con la membrana bacteriana (Holmes, Heylings, Wan, & Moss, 2019). Estos mismos autores demostraron que los dendrímeros PAMAM catiónicos fueron más efectivos contra bacterias Gram-negativas (como E. coli) que Gram-positivas (S. aureus).
Por otro lado, los dendrímeros con propiedades anti-virales poseen grupos aniónicos en su superficie, como sulfonatos o ácido siálico. Esta carga negativa les permite interactuar con los virus y competir en el proceso de fijación del virus a la superficie celular. Se ha reportado que dendrímeros de PLL modificados con grupos naftol o sulfonato en la superficie inhibieron la propagación in vitro del virus herpes simple, al impedir la entrada del virus a las células y su posterior replicación (Bourne et al., 2000). Del mismo modo, dendrímeros PAMAM modificados con naftol-sulfonato mostraron efectos similares contra el virus de inmunodeficiencia humana (VIH) (Witvrouw et al., 2018). La empresa australiana Starpharma ha desarrollado el producto VivaGel ®, un gel de carbopol cuyo componente activo son dendrímeros polianiónicos con un core de bencilhidramina-amida-lisina y 32 grupos naftaleno-disulfonato superficiales (Rupp, Rosenthal, & Stanberry, 2007), y han demostrado que estos dendrímeros se unen a la proteína gp120 del VIH e impiden su fijación a los receptores CD4 celulares, por lo que previene/reduce la transmisión sexual del VIH y de otras enfermedades virales de transmisión sexual. Este producto fue aprobado por la FDA en 2008 para su empleo en humanos; desde entonces ha demostrado ser eficiente además contra la propagación de los virus de herpes simple y de la hepatitis B, y contra la bacteria que produce clamidia (Hsu et al., 2017).
Además, se ha reportado que los dendrímeros pueden actuar como inhibidores de la enzima acetilcolinesterasa (AChE). Particularmente, Klajnert y col. (2004) estudiaron el efecto de dendrímeros PAMAM G4.0 sobre la actividad de la AChE en membranas de glóbulos rojos, demostrando que los dendrímeros catiónicos inhibieron a la enzima (B. Klajnert, Sadowska, & Bryszewska, 2004). Los autores propusieron que la inhibición ocurrió por dos procesos concomitantes: los dendrímeros se unen directamente a la enzima y modifican su estructura, impidiendo su acción catalítica, y los dendrímeros se unen a la membrana de los glóbulos rojos, generando cambios conformacionales en todas las enzimas transmembrana. Sin embargo, Shcharbin y col. (2006) estudiaron los efectos de los dendrímeros PAMAM G3.5 y G4.0 sobre la AChE comercial (en condiciones de no membrana), y los dendrímeros efectivamente redujeron la actividad enzimática de modo concentración-dependiente. En este trabajo, se confirmó que los dendrímeros catiónicos y aniónicos se unen a la enzima y modifican su estructura, actuando como inhibidores no competitivos (Shcharbin, Jokiel, Klajnert, & Bryszewska, 2006).
Por otro lado, los dendrímeros se han estudiado in vitro e in vivo en modelos animales por sus propiedades intrínsecas para prevenir la agregación y fibrilación de las proteínas Aβ, PrP y α-sinucleína (de la Torre, 2018). Por ejemplo, Wasiak y col. (2012 y 2015) demostraron que fosfodendrímeros de G3.0 y G4.0 con grupos terminales catiónicos impidieron la formación de fibras a partir de monómeros de Aβ28 y de Tau (ambos relacionados con la etiología de la EdA) (Wasiak et al., 2012, 2015). Por su parte, estudios realizados por Klajnert y col. (2006) han demostrado la capacidad de los dendrímeros PAMAM G3.0, G4.0 y G5.0 para impedir la agregación y formación de estructuras fibrilares amiloides a partir del péptido Aβ28 y del péptido PrP (relacionado con enfermedades priónicas). En estos estudios también demostraron que los dendrímeros PAMAM pueden interactuar con las proteínas amiloides combinando dos estrategias de inhibición de la fibrilación: la unión a las proteínas directamente, impidiendo la formación de nuevas fibras, y la unión a fibras pre-existentes, favoreciendo la ruptura de las mismas e impidiendo su crecimiento (Barbara Klajnert, Cortijo-Arellano, Bryszewska, & Cladera, 2006). En esta misma línea, Patel y col. (2007) estudiaron la acción de los dendrímeros PAMAM G3.0 y G4.0 con grupos de ácido siálico terminales, demostrando que los mismos atenuaron la toxicidad inducida por el péptido Aβ en cultivo celular (D. A. Patel, Henry, & Good, 2007). Finalmente, Milowska y col. (2011) estudiaron los efectos de los dendrímeros PAMAM G3.5 y G4.0 sobre la formación de fibras α-sinucleína, y observaron que solo los dendrímeros catiónicos presentaron un efecto inhibidor de la fibrilación (Milowska, Malachowska, & Gabryelak, 2011).
Sumado a las características mencionadas, se ha demostrado que los dendrímeros PAMAM poseen propiedades anti-inflamatorias (Durocher & Girard, 2016). Chauhan y col. (2009) reportaron que los dendrímeros PAMAM G4.0 presentaron actividad anti-inflamatoria en cultivo celular, incluso en mayor medida que la droga indometacina (Chauhan, Diwan, Jain, & Tomalia, 2009). Por otro lado, Neibert y col. (2013) demostraron las propiedades anti-inflamatorias de los dendrímeros PAMAM G0 y G1.0 en células de microglia estimuladas con lipopolisácarido; cuyos resultados sugieren que estos dendrímeros podrían actuar como inhibidores de las enzimas óxido nítrico sintasa y la ciclooxigenasa-2, ambas mediadoras del proceso inflamatorio (Neibert et al., 2013).
De aquí la importancia de considerar a los dendrímeros PAMAM no solo como nanotransportadoresde drogas sino como fármacos terapéuticos per se, que podrían ser utilizados en el tratamiento de diversas enfermedades o como potenciadores de los tratamientos pre-existentes en la generación de terapias combinadas, por sus propiedades anti-AChE, anti-agregación de proteínas y anti-inflamatorias.
Se ha reportado que los dendrímeros pueden administrarse por diversas vías, incluyendo la intravenosa, intraperitoneal, ocular, transdérmica, oral, intranasal, pulmonar, intravaginal y transmucosa (Mignani, El Kazzouli, Bousmina, & Majoral, 2013). Los dendrímeros son el único tipo de nanopartículas con las características adecuadas para ser utilizados en esta gran variedad de vías de administración.
Los dendrímeros han sido administrados por vía intravenosa en la mayoría de los estudios realizados en modelos animales murinos. Si bien esta vía de administración permitiría el acceso directo del nanotransportador al órgano o tejido blanco, es una ruta relativamente invasiva, sobre todo cuando se desarrollan tratamientos a largo plazo. Por ejemplo, se ha demostrado que conjugados de dendrímeros con la droga anti-tumoral doxorubicina fueron menos tóxicos y presentaron una mayor vida media en circulación que la droga libre (Padilla De Jesús, Ihre, Gagne, Fréchet, & Szoka, 2002). Por otro lado, Asthana y col. (2005) detectaron que la administración de complejos entre dendrímeros PAMAM G4.0 y el fármaco anti-inflamatorio flurbiprofeno en ratas albinas, generó un aumento del efecto anti-inflamatorio respecto del producido por la droga libre (Asthana, Chauhan, Diwan, & Jain, 2005). Pensando en rutas menos invasivas, se ha estudiado la potencialidad de los dendrímeros para ser administrados por la vía oral. En general, se ha encontrado que los dendrímeros PAMAM catiónicos fueron más permeables y capaces de atravesar la barrera intestinal, en comparación con dendrímeros aniónicos o neutros de la misma generación (M. El-Sayed, Rhodes, Ginski, & Ghandehari, 2003; Mohamed El-Sayed, Ginski, Rhodes, & Ghandehari, 2002; Kitchens, Kolhatkar, Swaan, Eddington, & Ghandehari, 2006; Kolhatkar, Swaan, & Ghandehari, 2008). Por ejemplo, estudios in vivo demostraron que la biodisponibilidad del 5-fluorouracilo y la doxorubicina aumentaron 1,7 y 200 veces, respectivamente, al administrarla por vía oral con dendrímeros PAMAM catiónicos (Ke et al., 2008; Tripathi et al., 2002).
Sumado a lo descripto, los dendrímeros PAMAM se han utilizado para el suministro transdérmico de moléculas bioactivas. Este es un método no invasivo, que permitiría mantener los niveles de droga en sangre relativamente estables, sin que ocurra el primer paso metabólico en el hígado. Por ejemplo, estudios in vivo demostraron que dendrímeros PAMAM G5.0 facilitaron la penetración en piel de ketoprofeno y diflunisal, mientras que dendrímeros G4.0 y G4.5 aumentaron 1,6 veces la permeabilidad de indometacina (Chauhan et al., 2003; Yiyun et al., 2007). Por otro lado, se ha demostrado que el pre-tratamiento de la piel con dendrímeros da lugar a una mayor permeabilidad del 5-fluorouracilo (Venuganti & Perumal, 2008). El incremento en la permeabilidad mediada por dendrímeros resultó ser carga- y generación-dependiente: los dendrímeros catiónicos y pequeños fueron más efectivos que los aniónicos y de mayores generaciones.
La administración intranasal de sistemas de delivery de drogas se ha vuelto un medio prometedor, debido a que la nariz tiene una gran superficie epitelial expuesta donde la droga se puede absorber. Además, la capa subepitelial se encuentra muy vascularizada y la sangre venosa que pasa por la nariz va directamente a la circulación sistémica, evitando el primer paso metabólico en el hígado. Sumado a ello es un método no invasivo y puede maximizar la complacencia del paciente (Dong, Katsumi, Sakane, & Yamamoto, 2010). Estudios in vivo reportaron una absorción nasal incrementada de insulina, calcitonina y haloperidol tras la administración con dendrímeros PAMAM catiónicos (Dong et al., 2010; Katare et al., 2015). Además, otro estudio reportó que los dendrímeros PAMAM G4.0 llegaron a cerebro tras la administración intranasal en ratones BALB/c (Win-Shwe et al., 2014).
Otras vías se han utilizado para la administración de dendrímeros, pero con el objetivo de estudiar la biodistribución de los mismos, más que su efecto en el transporte de drogas. Por ejemplo, Albertazzi y col. (2012) estudiaron la biodistribución de los dendrímeros PAMAM G4.0 marcados con el fluoróforo Alexa647 y reportaron que los dendrímeros fueron capaces de atravesar la barrera ependimal para llegar al parénquima cerebral luego de una inyección intraventricular (Albertazzi et al., 2013). Sumado a ello, Srinageshwar y col. (2017) estudiaron la biodistribución en ratones de dendrímeros PAMAM G4.0 conjugados con FTIC tras la administración intracraneal y por inyección en la carótida (menos invasivo). Es este caso, los dendrímeros atravesaron la BHE cuando fueron inyectados en la carótida y fueron localizados en el interior de las neuronas y las células gliales (Srinageshwar et al., 2017).
Albertazzi, L., Gherardini, L., Brondi, M., Sulis Sato, S., Bifone, A., Pizzorusso, T., … Bardi, G. (2013). In vivo distribution and toxicity of PAMAM dendrimers in the central nervous system depend on their surface chemistry. Molecular Pharmaceutics, 10(1), 249–260. https://doi.org/10.1021/mp300391v
Ammala, A. (2013). Biodegradable polymers as encapsulation materials for cosmetics and personal care markets. International Journal of Cosmetic Science, 35(2), 113–124. https://doi.org/10.1111/ics.12017
Asthana, A., Chauhan, A. S., Diwan, P. V., & Jain, N. K. (2005). Poly(amidoamine) (PAMAM) dendritic nanostructures for controlled sitespecific delivery of acidic anti-inflammatory active ingredient. AAPS PharmSciTech, 6(3), E536–E542. https://doi.org/10.1208/pt060367
Bezouška, K. (2002). Design, functional evaluation and biomedical applications of carbohydrate dendrimers (glycodendrimers). Reviews in Molecular Biotechnology, 90(3–4), 269–290. https://doi.org/10.1016/S1389-0352(01)00064-2
Boas, U., & Heegaard, P. M. H. (2004). Dendrimers in drug research. Chemical Society Reviews, 33(1), 43–63. https://doi.org/10.1039/b309043b
Bourne, N., Stanberry, L. R., Kern, E. R., Holan, G., Matthews, B., & Bernstein, D. I. (2000). Dendrimers, a new class of candidate topical microbicides with activity against herpes simplex virus infection. Antimicrobial Agents and Chemotherapy, 44(9), 2471–2474. https://doi.org/10.1128/AAC.44.9.2471-2474.2000
Buczkowski, A., Olesinski, T., Zbicinska, E., Urbaniak, P., & Palecz, B. (2015). Spectroscopic and calorimetric studies of formation of the supramolecular complexes of PAMAM G5-NH
Calabretta, M. K., Kumar, A., McDermott, A. M., & Cai, C. (2007). Antibacterial activities of poly(amidoamine) dendrimers terminated with amino and poly(ethylene glycol) groups. Biomacromolecules, 8(6), 1807–1811. https://doi.org/10.1021/bm0701088
Caminati, G., Turro, N. J., & Tomalia, D. A. (1990). Photophysical Investigation of Starburst Dendrimers and Their Interactions with Anionic and Cationic Surfactants. Journal of the American Chemical Society, 112(23), 8515–8522. https://doi.org/10.1021/ja00179a041
Chauhan, A. S., Diwan, P. V., Jain, N. K., & Tomalia, D. A. (2009). Unexpected in vivo anti-inflammatory activity observed for simple, surface functionalized poly(amidoamine) dendrimers. Biomacromolecules, 10(5), 1195–1202. https://doi.org/10.1021/bm9000298
Chauhan, A. S., Sridevi, S., Chalasani, K. B., Jain, A. K., Jain, S. K., Jain, N. K., & Diwan, P. V. (2003). Dendrimer-mediated transdermal delivery: Enhanced bioavailability of indomethacin. Journal of Controlled Release, 90(3), 335–343. https://doi.org/10.1016/S0168-3659(03)00200-1
Chen, C. Z., Beck-Tan, N. C., Dhurjati, P., Van Dyk, T. K., LaRossa, R. A., & Cooper, S. L. (2000). Quaternary ammonium functionalized poly(propylene imine) dendrimers as effective antimicrobials: Structure-activity studies. Biomacromolecules, 1(3), 473–480. https://doi.org/10.1021/bm0055495
Chen, C. Z., & Cooper, S. L. (2002). Interactions between dendrimer biocides and bacterial membranes. Biomaterials, 23(16), 3359–3368. https://doi.org/10.1016/S0142-9612(02)00036-4
Chen, W., Tomalia, D. A., & Thomas, J. L. (2000). Unusual pH-dependent polarity changes in PAMAM dendrimers: evidence for pH-responsive conformational changes. Macromolecules, 33(25), 9169–9172. https://doi.org/10.1021/ma000791p
Choudhary, S., Gupta, L., Rani, S., Dave, K., & Gupta, U. (2017). Impact of dendrimers on solubility of hydrophobic drug molecules. Frontiers in Pharmacology, Vol. 8, p. 261. https://doi.org/10.3389/fphar.2017.00261
D’Emanuele, A., & Attwood, D. (2005). Dendrimer-drug interactions. Advanced Drug Delivery Reviews, 57(15), 2147–2162. https://doi.org/10.1016/j.addr.2005.09.012
de la Torre, J. (2018). The Vascular Hypothesis of Alzheimer’s Disease: A Key to Preclinical Prediction of Dementia Using Neuroimaging. Journal of Alzheimer’s Disease : JAD, 63(1), 35–52. https://doi.org/10.3233/JAD-180004
Dong, Z., Katsumi, H., Sakane, T., & Yamamoto, A. (2010). Effects of polyamidoamine (PAMAM) dendrimers on the nasal absorption of poorly absorbable drugs in rats. International Journal of Pharmaceutics, 393(1–2), 245–253. https://doi.org/10.1016/j.ijpharm.2010.04.021
Duncan, R., & Izzo, L. (2005). Dendrimer biocompatibility and toxicity. Advanced Drug Delivery Reviews, 57(15), 2215–2237. https://doi.org/10.1016/j.addr.2005.09.019
Durocher, I., & Girard, D. (2016). In vivo proinflammatory activity of generations 0–3 (G0–G3) polyamidoamine (PAMAM) nanoparticles. Inflammation Research. https://doi.org/10.1007/s00011-016-0959-5
Eichman, J. D., Bielinska, A. U., Kukowska-Latallo, J. F., & Baker, J. R. (2000). The use of PAMAM dendrimers in the efficient transfer of genetic material into cells. Pharmaceutical Science and Technology Today, 3(7), 232–245. https://doi.org/10.1016/S1461-5347(00)00273-X
El-Sayed, M., Rhodes, C. A., Ginski, M., & Ghandehari, H. (2003). Transport mechanism(s) of poly (amidoamine) dendrimers across Caco-2 cell monolayers. International Journal of Pharmaceutics, 265(1–2), 151–157. https://doi.org/10.1016/S0378-5173(03)00391-0
El-Sayed, Mohamed, Ginski, M., Rhodes, C., & Ghandehari, H. (2002). Transepithelial transport of poly(amidoamine) dendrimers across Caco-2 cell monolayers. Journal of Controlled Release, 81(3), 355–365. https://doi.org/10.1016/S0168-3659(02)00087-1
Esfand, R., & Tomalia, D. A. (2001). Laboratory Synthesis of Poly ( amidoamine ) ( PAMAM ) Dendrimers. Dendrimer and Other Dendritic Polymers, 1, 587–604. https://doi.org/https://doi.org/10.1002/0470845821.ch25
Fréchet, J. M., & Tomalia, D. A. (2003). Dendrimers and Other Dendritic Polymers. In Dendrimers and Other Dendritic Polymers. https://doi.org/10.1002/0470845821
Gupta, U., & Perumal, O. (2014). Dendrimers and Its Biomedical Applications. Natural and Synthetic Biomedical Polymers, 243–257. https://doi.org/10.1016/B978-0-12-396983-5.00016-8
Hawker, C. J., & Fréchet, J. M. J. (1990). Preparation of Polymers with Controlled Molecular Architecture. A New Convergent Approach to Dendritic Macromolecules. Journal of the American Chemical Society, 112(21), 7638–7647. https://doi.org/10.1021/ja00177a027
Holmes, A. M., Heylings, J. R., Wan, K. W., & Moss, G. P. (2019). Antimicrobial efficacy and mechanism of action of poly(amidoamine) (PAMAM) dendrimers against opportunistic pathogens. International Journal of Antimicrobial Agents, 53(4), 500–507. https://doi.org/10.1016/j.ijantimicag.2018.12.012
Hsu, H. J., Bugno, J., Lee, S. R., & Hong, S. (2017). Dendrimer-based nanocarriers: a versatile platform for drug delivery. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology, 9(1), e1409. https://doi.org/10.1002/wnan.1409
Jain, K., Kesharwani, P., Gupta, U., & Jain, N. K. (2010). Dendrimer toxicity: Let’s meet the challenge. International Journal of Pharmaceutics, 394(1–2), 122–142. https://doi.org/10.1016/j.ijpharm.2010.04.027
Kalomiraki, M., Thermos, K., & Chaniotakis, N. A. (2015). Dendrimers as tunable vectors of drug delivery systems and biomedical and ocular applications. International Journal of Nanomedicine, 11, 1–12. https://doi.org/10.2147/IJN.S93069
Katare, Y. K., Daya, R. P., Sookram Gray, C., Luckham, R. E., Bhandari, J., Chauhan, A. S., & Mishra, R. K. (2015). Brain Targeting of a Water Insoluble Antipsychotic Drug Haloperidol via the Intranasal Route Using PAMAM Dendrimer. Molecular Pharmaceutics, 12(9), 3380–3388. https://doi.org/10.1021/acs.molpharmaceut.5b00402
Ke, W., Zhao, Y., Huang, R., Jiang, C., & Pei, Y. (2008). Enhanced oral bioavailability of doxorubicin in a dendrimer drug delivery system. Journal of Pharmaceutical Sciences, 97(6), 2208–2216. https://doi.org/10.1002/jps.21155
Kesharwani, P., Jain, K., & Jain, N. K. (2014). Dendrimer as nanocarrier for drug delivery. Progress in Polymer Science, 39(2), 268–307. https://doi.org/10.1016/j.progpolymsci.2013.07.005
Kitchens, K. M., Kolhatkar, R. B., Swaan, P. W., Eddington, N. D., & Ghandehari, H. (2006). Transport of poly(amidoamine) dendrimers across Caco-2 cell monolayers: Influence of size, charge and fluorescent labeling. Pharmaceutical Research, 23(12), 2818–2826. https://doi.org/10.1007/s11095-006-9122-2
Klajnert, B., Sadowska, M., & Bryszewska, M. (2004). The effect of polyamidoamine dendrimers on human erythrocyte membrane acetylcholinesterase activity. Bioelectrochemistry, 65(1), 23–26. https://doi.org/10.1016/j.bioelechem.2004.06.004
Klajnert, Barbara, Cortijo-Arellano, M., Bryszewska, M., & Cladera, J. (2006). Influence of heparin and dendrimers on the aggregation of two amyloid peptides related to Alzheimer’s and prion diseases. Biochemical and Biophysical Research Communications, 339(2), 577–582. https://doi.org/10.1016/j.bbrc.2005.11.053
Kolhatkar, R. B., Swaan, P., & Ghandehari, H. (2008). Potential oral delivery of 7-ethyl-10-hydroxy-camptothecin (SN-38) using poly(amidoamine) dendrimers. Pharmaceutical Research, 25(7), 1723–1729. https://doi.org/10.1007/s11095-008-9572-9
Kolhe, P., Misra, E., Kannan, R. M., Kannan, S., & Lieh-Lai, M. (2003). Drug complexation, in vitro release and cellular entry of dendrimers and hyperbranched polymers. International Journal of Pharmaceutics, 259(1–2), 143–160. https://doi.org/10.1016/S0378-5173(03)00225-4
Lundquist, J. J., & Toone, E. J. (2002). The Cluster Glycoside Effect. Chemical Reviews, 102(2), 555–578. https://doi.org/10.1021/cr000418f
Maiti, P. K., Çaǧin, T., Lin, S. T., & Goddard, W. A. (2005). Effect of solvent and pH on the structure of PAMAM dendrimers. Macromolecules, 38(3), 979–991. https://doi.org/10.1021/ma049168l
Maiti, P. K., Çaǧin, T., Wang, G., & Goddard, W. A. (2004). Structure of PAMAM dendrimers: Generations 1 through 11. Macromolecules, 37(16), 6236–6254. https://doi.org/10.1021/ma035629b
Markowicz-Piasecka, M., & Mikiciuk-Olasik, E. (2016). Dendrimers in drug delivery. Nanobiomaterials in Drug Delivery: Applications of Nanobiomaterials, 39–74. https://doi.org/10.1016/B978-0-323-42866-8.00002-2
Menjoge, A. R., Kannan, R. M., & Tomalia, D. A. (2010, March 1). Dendrimer-based drug and imaging conjugates: design considerations for nanomedical applications. Drug Discovery Today, Vol. 15, pp. 171–185. https://doi.org/10.1016/j.drudis.2010.01.009
Mignani, S., Bryszewska, M., Zablocka, M., Klajnert-Maculewicz, B., Cladera, J., Shcharbin, D., & Majoral, J. P. (2017). Can dendrimer based nanoparticles fight neurodegenerative diseases? Current situation versus other established approaches. Progress in Polymer Science, 64, 23–51. https://doi.org/10.1016/j.progpolymsci.2016.09.006
Mignani, S., El Kazzouli, S., Bousmina, M., & Majoral, J. P. (2013). Expand classical drug administration ways by emerging routes using dendrimer drug delivery systems: A concise overview. Advanced Drug Delivery Reviews, 65(10), 1316–1330. https://doi.org/10.1016/j.addr.2013.01.001
Milowska, K., Malachowska, M., & Gabryelak, T. (2011). PAMAM G4 dendrimers affect the aggregation of α-synuclein. International Journal of Biological Macromolecules. https://doi.org/10.1016/j.ijbiomac.2011.02.021
Mohanty, C., Das, M., & Sahoo, S. K. (2012). Emerging role of nanocarriers to increase the solubility and bioavailability of curcumin. Expert Opinion on Drug Delivery, 9(11), 1347–1364. https://doi.org/10.1517/17425247.2012.724676
Nagahori, N., Lee, R. T., Nishimura, S. I., Pagé, D., Roy, R., & Lee, Y. C. (2002). Inhibition of adhesion of type 1 fimbriated Escherichia coli to highly mannosylated ligands. ChemBioChem, 3(9), 836–844. https://doi.org/10.1002/1439-7633(20020902)3:9<836::AID-CBIC836>3.0.CO;2-2
Najlah, M., & D’Emanuele, A. (2007). Synthesis of dendrimers and drug-dendrimer conjugates for drug delivery. Current Opinion in Drug Discovery & Development, 10(6), 756–767.
Nance, E., Zhang, F., Mishra, M. K., Zhang, Z., Kambhampati, S. P., Kannan, R. M., & Kannan, S. (2016). Nanoscale effects in dendrimer-mediated targeting of neuroinflammation. Biomaterials, 101, 96–107. https://doi.org/10.1016/j.biomaterials.2016.05.044
Neibert, K., Gosein, V., Sharma, A., Khan, M., Whitehead, M. A., Maysinger, D., & Kakkar, A. (2013). “Click” dendrimers as anti-inflammatory agents: With insights into their binding from molecular modeling studies. Molecular Pharmaceutics, 10(6), 2502–2508. https://doi.org/10.1021/mp4000508
Newkome, G. R., Yao, Z., Baker, G. R., & Gupta, V. K. (1985). Micelles. Part 1. Cascade molecules: a new approach to micelles. A [27]-arborol. The Journal of Organic Chemistry, 50(11), 2003–2004.
Padilla De Jesús, O. L., Ihre, H. R., Gagne, L., Fréchet, J. M. J., & Szoka, F. C. (2002). Polyester dendritic systems for drug delivery applications: In vitro and in vivo evaluation. Bioconjugate Chemistry, 13(3), 453–461. https://doi.org/10.1021/bc010103m
Patel, D. A., Henry, J. E., & Good, T. A. (2007). Attenuation of β-amyloid-induced toxicity by sialic-acid-conjugated dendrimers: Role of sialic acid attachment. Brain Research, 1161(1), 95–105. https://doi.org/10.1016/j.brainres.2007.05.055
Patel, J., Basu, B., Dharamsi, A., Garala, K., & Raval, M. (2011). Solubility of aceclofenac in polyamidoamine dendrimer solutions. International Journal of Pharmaceutical Investigation, 1(3), 135. https://doi.org/10.4103/2230-973x.85962
Prieto, M. J., Schilrreff, P., Tesoriero, M. V. D., Morilla, M. J., & Romero, E. L. (2008). Brain and muscle of Wistar rats are the main targets of intravenous dendrimeric sulfadiazine. International Journal of Pharmaceutics, 360(1–2), 204–212. https://doi.org/10.1016/j.ijpharm.2008.04.045
Prieto, Maria Jimena, Del Rio Zabala, N. E., Marotta, C. H., Bichara, D. R. D., Simonetta, S. H., Chiaramoni, N. S., & Alonso, S. del V. (2014). G4.5 Pamam Dendrimer-Risperidone: Biodistribution and Behavioral Changes in In Vivo Model. Journal of Nanomedicine & Biotherapeutic Discovery, 04(01), 1–11. https://doi.org/10.4172/2155-983x.1000121
Prieto, María Jimena, Temprana, C. F., Del Río Zabala, N. E., Marotta, C. H., & Alonso, S. D. V. (2011). Optimization and in vitro toxicity evaluation of G4
PAMAM dendrimer-risperidone complexes. European Journal of Medicinal Chemistry, 46(3), 845–850. https://doi.org/10.1016/j.ejmech.2010.12.021
Qiao, Z., & Shi, X. (2015, May 1). Dendrimer-based molecular imaging contrast agents. Progress in Polymer Science, Vol. 44, pp. 1–27. https://doi.org/10.1016/j.progpolymsci.2014.08.002
Quintana, A., Raczka, E., Piehler, L., Lee, I., Myc, A., Majoros, I., … Baker, J. R. (2002). Design and function of a dendrimer-based therapeutic nanodevice targeted to tumor cells through the folate receptor. Pharmaceutical Research, 19(9), 1310–1316. https://doi.org/10.1023/A:1020398624602
Reek, J. N. H., Arévalo, S., van Heerbeek, R., Kamer, P. C. J., & van Leeuwen, P. W. N. M. (2006). Dendrimers in Catalysis. Advances in Catalysis, 49, 71–151. https://doi.org/10.1016/S0360-0564(05)49002-1
Rupp, R., Rosenthal, S. L., & Stanberry, L. R. (2007). VivaGel (SPL7013 Gel): a candidate dendrimer--microbicide for the prevention of HIV and HSV infection. International Journal of Nanomedicine, 2(4), 561–566. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/18203424%0Ahttp://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=PMC2676817
Sepúlveda-Crespo, D., Ceña-Díez, R., Jiménez, J. L., & Ángeles Muñoz-Fernández, M. (2017). Mechanistic Studies of Viral Entry: An Overview of Dendrimer-Based Microbicides As Entry Inhibitors Against Both HIV and HSV-2 Overlapped Infections. Medicinal Research Reviews, 37(1), 149–179. https://doi.org/10.1002/med.21405
Shcharbin, D., Jokiel, M., Klajnert, B., & Bryszewska, M. (2006). Effect of dendrimers on pure acetylcholinesterase activity and structure. Bioelectrochemistry, 68(1), 56–59. https://doi.org/10.1016/j.bioelechem.2005.04.001
Sheikhpour, M., Barani, L., & Kasaeian, A. (2017). Biomimetics in drug delivery systems: A critical review. Journal of Controlled Release, 253, 97–109. https://doi.org/10.1016/j.jconrel.2017.03.026
Sowinska, M., & Urbanczyk-Lipkowska, Z. (2014). Advances in the chemistry of dendrimers. New Journal of Chemistry, 38(6), 2168–2203. https://doi.org/10.1039/c3nj01239e
Srinageshwar, B., Peruzzaro, S., Andrews, M., Johnson, K., Hietpas, A., Clark, B., … Rossignol, J. (2017). PAMAM dendrimers cross the blood–brain barrier when administered through the carotid artery in C57BL/6J mice. International Journal of Molecular Sciences, Vol. 18. https://doi.org/10.3390/ijms18030628
Suarez, I. J., Rosal, R., Rodriguez, A., Ucles, A., Fernandez-Alba, A. R., Hernando, M. D., & García-Calvo, E. (2011). Chemical and ecotoxicological assessment of poly(amidoamine) dendrimers in the aquatic environment. TrAC - Trends in Analytical Chemistry, 30(3), 492–506. https://doi.org/10.1016/j.trac.2010.11.009
Svenson, S., & Tomalia, D. A. (2012). Dendrimers in biomedical applications-reflections on the field. Advanced Drug Delivery Reviews, 64(SUPPL.), 102–115. https://doi.org/10.1016/j.addr.2012.09.030
Tomalia, D A, Baker, H., Dewald, J., Hall, M., Kallos, G., Martin, S., … Smith, P. (1985). A New Class of Polymers: Starburst-Dendritic Macromolecules. Polymer Journal, 17(1), 117–132. https://doi.org/10.1295/polymj.17.117
Tomalia, Donald A., Naylor, A. M., & Goddard, W. A. (1990). Starburst Dendrimers: Molecular‐Level Control of Size, Shape, Surface Chemistry, Topology, and Flexibility from Atoms to Macroscopic Matter. Angewandte Chemie International Edition in English, 29(2), 138–175. https://doi.org/10.1002/anie.199001381
Tripathi, P. K., Khopade, A. J., Nagaich, S., Shrivastava, S., Jain, S., & Jain, N. K. (2002). Dendrimer grafts for delivery of 5-flurouracil. Pharmazie, 57(4), 261–264. Retrieved from http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L34297503
Venuganti, V. V. K., & Perumal, O. P. (2008). Effect of poly(amidoamine) (PAMAM) dendrimer on skin permeation of 5-fluorouracil. International Journal of Pharmaceutics, 361(1–2), 230–238. https://doi.org/10.1016/j.ijpharm.2008.05.034
Wasiak, T., Ionov, M., Nieznanski, K., Nieznanska, H., Klementieva, O., Granell, M., … Klajnert, B. (2012). Phosphorus dendrimers affect Alzheimer’s (Aβ 1-28 ) peptide and MAP-Tau protein aggregation. Molecular Pharmaceutics, 9(3), 458–469. https://doi.org/10.1021/mp2005627
Wasiak, T., Marcinkowska, M., Pieszynski, I., Zablocka, M., Caminade, A. M., Majoral, J. P., & Klajnert-Maculewicz, B. (2015). Cationic phosphorus dendrimers and therapy for Alzheimer’s disease. New Journal of Chemistry, 39(6), 4852–4859. https://doi.org/10.1039/c5nj00309a
Win-Shwe, T. T., Sone, H., Kurokawa, Y., Zeng, Y., Zeng, Q., Nitta, H., & Hirano, S. (2014). Effects of PAMAM dendrimers in the mouse brain after a single intranasal instillation. Toxicology Letters, 228(3), 207–215. https://doi.org/10.1016/j.toxlet.2014.04.020
Witvrouw, M., Fikkert, V., Pluymers, W., Matthews, B., Mardel, K., Schols, D., … Pannecouque, C. (2018). Polyanionic (i.e., Polysulfonate) Dendrimers Can Inhibit the Replication of Human Immunodeficiency Virus by Interfering with Both Virus Adsorption and Later Steps (Reverse Transcriptase/Integrase) in the Virus Replicative Cycle. Molecular Pharmacology, 58(5), 1100–1108. https://doi.org/10.1124/mol.58.5.1100
Yang, J., Zhang, Q., Chang, H., & Cheng, Y. (2015). Surface-Engineered Dendrimers in Gene Delivery. Chemical Reviews, 115(11), 5274–5300. https://doi.org/10.1021/cr500542t
Yiyun, C., Na, M., Tongwen, X., Rongqiang, F., Xueyuan, W., Xiaomin, W., & Longping, W. (2007). Transdermal delivery of nonsteroidal anti-inflammatory drugs mediated by polyamidoamine (PAMAM) dendrimers. Journal of Pharmaceutical Sciences, 96(3), 595–602. https://doi.org/10.1002/jps.20745

