Los nanoconstructos biohíbridos con direccionamiento celular específico para futuras aplicaciones en diagnóstico in vivo y tratamiento del cáncer
Biohybrid nanocontructs with specific cell targeting for future applications in in vivo diagnosis and cancer treatment
Constanza Y. Flores Estefanía E. Achilli Mariano GrasselliEl cáncer es un problema importante de salud pública en todo el mundo (Siegel, Miller, Jemal, 2019). Este término genérico engloba un grupo de enfermedades que tienen como característica definitoria la multiplicación rápida de células anormales, que pueden invadir partes adyacentes del cuerpo o propagarse a otros órganos en un proceso denominado metástasis. El cáncer es la segunda causa de muerte a nivel mundial (OMS, 2018), y según datos disponibles del año 2018, la Agencia Internacional de Investigación sobre Cáncer (IARC) posiciona a la Argentina dentro de los países con una tasa de incidencia media-alta (entre 177 y 245,6 casos por 100.000 habitantes). Esto nos ubica en el séptimo lugar entre los países de Latinoamérica, con más de 125.000 nuevos casos por año (Instituto Nacional del Cáncer, 2020).
Muchas investigaciones están dirigidas al desarrollo de distintas estrategias de diseño de fármacos para el diagnóstico y tratamiento del cáncer. Se han realizado enormes avances en el tratamiento, prevención y detección temprana de tumores malignos. Sin embargo, ninguna de las terapias actuales puede cubrir específicamente todas las variantes de esta enfermedad, que difieren en sus características histopatológicas y que además, presentan variaciones genómicas y genéticas entre sí (Gupta, Massagué, 2006). Algunos problemas importantes asociados a las terapias actuales es la necesidad de administrar altas concentraciones de fármaco debido a un ineficiente o ausente direccionamiento de los mismos hacia células tumorales y sitios de metástasis (Van't Veer, et al., 2002; Pugazhendhi, Edison, Karuppusamy, Kathirvel, 2018).
En las últimas décadas, distintos enfoques basados en la Nanotecnología comenzaron a tener relevancia en la búsqueda de nuevas estrategias teranósticas. Esta rama de la tecnología, que implica la manipulación de la materia en la escala nanométrica, permite a los investigadores combinar las propiedades de múltiples materiales (por ejemplo, compuestos inorgánicos y/u orgánicos, biomoléculas, fármacos terapéuticos, etc.) para generar arquitecturas multifuncionales con potenciales aplicaciones médicas. De esta manera surge la Nanomedicina, que se define como la aplicación clínica de la Nanotecnología en las áreas de detección, diagnóstico y tratamiento de enfermedades (Moghimi, Hunter, Murray, 2005).
En este contexto, los nanomateriales inorgánicos adquirieron relevancia gracias a que sus características ópticas y magnéticas únicas los hacen útiles para la terapia del cáncer (Abadeer, Murphy, 2016; Yang, et al., 2017), el diagnóstico por imagen (Rand, et al., 2011; Shin, Choi, Kim, Cheon, 2015) y también, como posibles herramientas teranósticas al combinar ambas propiedades (Kong, Zhang, Li, Wang, Wang, Wang, 2017; Zhu, Zhou, Mao, Yang, 2017; Hainfeld, Smilowitz, O’Connor, Dilmanian, Slatkin, 2013). En particular, las nanopartículas (NPs), o partículas de forma esférica con un diámetro menor a 200 nm, son los nanomateriales más estudiados para aplicaciones en Nanomedicina. Este límite superior en el tamaño de las mismas se debe a que fue demostrado que las NPs con un diámetro mayor a 200 nm son eliminadas rápidamente del torrente sanguíneo, acumulándose en hígado y bazo (Hoshyar, Gray, Han, Bao, 2016).
Las NPs de oro (AuNPs) constituyen uno de los nanomateriales inorgánicos más atractivos desde el punto de vista de salud humana. Son relativamente inertes y se consideran biocompatibles y no tóxicas (Nie, Chen, 2012). Además, la absorbancia y la fluorescencia de las AuNPs son mayores en comparación con el oro sólido. Estas NPs pueden cambiar sus propiedades absortivas desde la región visible al infrarrojo cercano (NIR), sólo por cambios en el tamaño y la morfología del nanoconstructo. Dado que el tejido biológico absorbe luz débilmente en la región NIR, son ideales para aplicaciones basadas en óptica (Mieszawska, Mulder, Fayad, Cormode, 2013). Adicionalmente, se ha demostrado que absorben fuertemente los rayos X y, por lo tanto, pueden usarse como agentes de contraste para las técnicas de imágenes basadas en estos rayos (Manohar, Reynoso, Diagaradjane, Krishnan, Cho, 2016), y como adyuvantes para la radioterapia (Cui, Her, Borst, Bristow, Jaffray, Allen, 2017). Otra propiedad de las AuNPs es la de transformar muy eficientemente la luz absorbida en calor, lo que da como resultado un aumento localizado de la temperatura, que puede usarse para proporcionar contraste en imágenes fotoacústicas o para la terapia fototérmica (Huang, Jain, El-Sayed, El-Sayed, 2007; Ghosh, Han, De, Kim, Rotello, 2008).
Muchos trabajos de investigación han buscado desarrollar NPs (como las AuNPs) para aplicaciones in vivo, con señales de direccionamiento al sitio blanco de acción, como por ejemplo células tumorales o tejidos anormales. Las AuNPs fueron muy utilizadas, ya que se pueden modificar fácilmente, introduciendo ligandos de direccionamiento, fármacos o recubrimientos biocompatibles, lo que permite la preparación de nanoconstrucciones multifuncionales (Saha, Agasti, Kim, Li, Rotello, 2012). Para ello, se utiliza la funcionalización superficial de las NPs con diferentes moléculas tales como vitaminas (Shakeri-Zadeh, Mansoori, Hashemian, Eshghi, Sazgarnia, Montazerabadi, 2010; Samadian, Hosseini-Nami, Kamrava, Ghaznavi, Shakeri-Zadeh, 2016), péptidos (Sun, Liu, Wang, 2008; Velasco-Aguirre, et al., 2015), proteínas (Yang, Sun, Chiu, Sun, He, 2005), y oligonucleótidos (Rosi, Giljohann, Thaxton, Lytton-Jean, Han, Mirkin, 2006; Dhar, Daniel, Giljohann, Mirkin, Lippard, 2009), entre otros. Muchas nanoconstrucciones han demostrado selectividad en el direccionamiento hacia células específicas en ensayos en cultivos celulares in vitro, estudiando la interacción de las NPs y las células en ausencia de proteínas séricas en los medios de cultivo. Sin embargo, estudios científicos más recientes han demostrado que no es posible extrapolar estos resultados a aplicaciones in vivo que involucren la administración endovenosa de estas NPs en el cuerpo humano.
Wilhelm et al. (2016) realizó un análisis bibliográfico estadístico de las publicaciones científicas del área de Nanomedicina de los últimos 10 años, que incluye todos los tipos y composición de NPs. Del estudio se confirma que en promedio sólo el 0,7 % de NPs administradas logran llegar a un tumor sólido in vivo. Esto evidencia que existe una incapacidad para controlar el transporte de NPs dentro del cuerpo, lo que representa la mayor limitación en el uso de la Nanotecnología para diagnosticar y tratar enfermedades (Polo, Collado, Pelaz, Del Pino, 2017). Este estudio ha hecho redefinir las características de diseño de las NPs para aplicaciones en Nanomedicina, siendo prioritario tener en cuenta las barreras biológicas que deberán atravesar los nanoconstructos in vivo.
Es por ello que los nuevos ensayos de NPs y células in vitro deben simular las condiciones fisiológicas a las que se verán expuestas las NPs en el cuerpo humano. Comprender la interacción de las mismas con proteínas y células en estas condiciones es esencial para el desarrollo de herramientas teranósticas y para superar las limitaciones existentes en el direccionamiento selectivo de nanoconstructos (Wilhelm, et al., 2016; Verma, Stellacci, 2010).
Cuando las NPs entran en contacto con el medio biológico, interaccionan con diferentes moléculas de su entorno (principalmente con proteínas presentes en el suero) que forman un recubrimiento a su alrededor, confiriéndoles una nueva identidad biológica. Este proceso complejo y dinámico es conocido como “Efecto Corona” (Cedervall, et al., 2007; Mohammadi, Corbo, Molinaro, Lakey, 2019), y afecta el transporte de las NPs a través de los medios biológicos, la absorción y respuesta celular, con consecuencias significativas en la eficiencia terapéutica (Damalakiene, Karabanovas, Bagdonas, Valius, Rotomskis, 2013). Este fenómeno puede explicarse a partir de la biofísica y la termodinámica. La interacción de las NPs y las proteínas es favorecida por la entalpía de interacción y un gran efecto entrópico por el desplazamiento de las capas de hidratación de ambas macroestructuras. Las consecuencias de tales interacciones bio-nano son el incremento en la solubilidad de las NPs que pueden desencadenar procesos biofísicos de desplegamiento y agregación de proteínas sobre su superficie, cambiando la estructura nativa 3D de las mismas. Como resultado final, el Efecto Corona enmascara las funcionalidades químicas o biológicas impartidas a los nanoconstructos preparados en el laboratorio (Ke, Lin, Parak, Davis, Caruso, 2017). La composición de esta corona proteica está fuertemente correlacionada con características de las NPs tales como composición, tamaño y forma, por lo que podría modularse mediante la química de superficie de las mismas. En la actualidad, se han incrementado el número de publicaciones científicas sobre este efecto; sin embargo, los estudios sistemáticos de la interacción de las NPs (de diferentes características fisicoquímicas) con el plasma sanguíneo no han logrado encontrar una correlación entre las características propias de las NPs y la corona proteica (Lee, Choi, Webster, Kim, Khang, 2014). Esto nos indica que las superficies generadas de manera sintética por el hombre no llegan a tener el grado de complejidad necesaria para evitar las miles de interacciones débiles, especialmente las tipo puente hidrógeno e interacciones de Van der Walls, que actúan de manera cooperativa y que son las responsables finales del Efecto Corona.
En consecuencia, es fundamental el estudio del Efecto Corona de las NPs in vitro, en un entorno similar al biológico para poder determinar, si en estas condiciones, existe o no interacción de las mismas con las proteínas plasmáticas y con diferentes tipos celulares.
La corona proteica no es la única barrera a la que estarán expuestas las NPs en los sistemas biológicos. También será necesario tener una interacción específica con la membrana celular que favorezca el ingreso a la célula. De esta manera, una nanomedicina ideal debería diseñarse para lograr los siguientes objetivos in vivo: i) interaccionar sólo con células y tejidos específicos; ii) tener un tiempo de circulación prolongado (evitando la rápida eliminación renal); iii) evitar una acumulación importante en el hígado y el bazo; iv) evitar el secuestro por el sistema fagocítico mononuclear (MPS) (Wilhelm S., et al., 2016). En teoría, todos estos objetivos pueden lograrse modulando las características específicas de diseño de las NPs, tales como tamaño, carga superficial, recubrimientos, ligandos expuestos en superficie, entre otros (Verma, Stellacci, 2010; Lundqvist, Stigler, Elia, Lynch, Cedervall, Dawson; 2008; Zhao, Zhao, Liu, Chang, Chen, Zhao, 2011).
Considerando los diferentes materiales disponibles para la preparación de nanoconstructos, las NPs preparadas a partir de proteínas han demostrado una alta biocompatibilidad. Las NPs basadas en Albúmina se han diseñado para una variedad de usos dentro de los cuales se destaca su utilización como nanovehículos en sistemas de entrega selectiva de fármacos. La Albúmina constituye aproximadamente el 50% de las proteínas presentes en el plasma de individuos sanos. Esta proteína multifuncional puede unir y transportar numerosos compuestos endógenos y exógenos. Se puede encontrar en grandes cantidades en el sistema circulatorio y el espacio extracelular; sin embargo, está completamente ausente en el citoplasma celular. Es una proteína con alta biocompatibilidad y biodegradación hasta aminoácidos individuales (Herrera, Champion, 2015). Estas características la convierten en un material con un gran potencial de aplicación en Nanomedicina.
Un conocido caso de éxito en el tratamiento del cáncer, son las NPs de Albúmina unidas a Paclitaxel, conocido por su nombre comercial Abraxane®. Este producto reemplazó al Taxol, una emulsión oleosa de Paclitaxel, reduciendo drásticamente su toxicidad. El Abraxane® se aprobó para el tratamiento del cáncer de mama metastásico, administrándose por primera vez en pacientes donde los tratamientos de quimioterapia habían fallado. En 2012, también fue aprobado para el tratamiento del cáncer de pulmón de células no pequeñas (NSCLC) (Green, et al. 2006; Siri, Achilli, Grasselli, Alonso, 2017). Cabe destacar que estas NPs no tienen ningún ligando específico para su direccionamiento a las células blanco. Sin embargo, en 2014 fue descripta cierta acumulación en tumores, que se describió como un "Efecto mejorado de permeabilidad y retención", también llamado EPR (Kobayashi, Watanabe, Choyke, 2014). Años más tarde, este efecto ha generado controversias en la comunidad científica, ya que diferentes estudios muestran resultados contradictorios (Van der Meel, Lammers, Hennink; 2017; Bor, Mat Azmi, Yaghmur, 2019).
Más de una década después de la aprobación de Abraxane®, se han realizado pocos avances con el fin de mejorar la selectividad de este nanovehículo para abordar las células tumorales in vivo mediante el agregado de ligandos específicos de direccionamiento. Una posible explicación es que esta NP está preparada a partir de interacciones no covalentes entre sus componentes (Albúmina-Albúmina y Albúmina-Paclitaxel), permitiendo el intercambio de Albúminas del Abraxane® cuando se encuentra expuesto a un medio con alto contenido proteico. Por lo tanto, las señales de direccionamiento agregadas a estas NPs se perderán al inyectarse en el torrente sanguíneo.
Recientemente también se ha revisado la importancia de dotar de una "identidad biológica" a las NPs sintéticas como un enfoque para mejorar la interacción con el medio biológico (Mohammadi, Corbo, Molinaro, Lakey, 2019). Existen algunas propuestas de nuevas nanoconstrucciones que combinan NPs preparadas de forma sintética con entidades biológicas, como membranas celulares, glúcidos, lípidos y proteínas (Mohammadi, Corbo, Molinaro, Lakey, 2019), que han llevado al desarrollo de las llamadas NPs biohíbridas (bioHNP). Estos nanomateriales serán candidatos prometedores para la Nanomedicina de próxima generación y la medicina personalizada si logran reducir la absorción inespecífica de proteínas plasmáticas, minimizando el Efecto Corona, y direccionar las NPs a las células blanco.
En este sentido, nuestro grupo de trabajo propone a la Albúmina como candidato para recubrir nanoconstrucciones inorgánicas para aplicaciones in vivo. Muy temprano en la era de la bio-nanotecnología, se informó que el recubrimiento previo de nanoésferas de poliestireno con Albúmina redujo su eliminación vía hepática mediada por receptores in vivo (Ogawara, et al., 2004). Sin embargo, el proceso de intercambio dinámico (descripto previamente) que ocurre entre estos nanoconstructos no covalentes, desestimó por muchos años la idea de la utilización de proteínas, y específicamente la Albúmina, como moléculas de recubrimiento.
Como describimos anteriormente, las interacciones de proteínas con AuNPs ocurren espontáneamente, aumentando su estabilidad coloidal. Sin embargo, esta interacción no covalente con las proteínas no es lo suficientemente estable, por lo que podrían llegar a liberarse de la superficie de las AuNPs e incluso intercambiarse con otras presentes en medios proteicos. Además, las proteínas pueden modificar su conformación al interaccionar con una NP y, también podrían tener una conformación diferente después de la liberación. Se ha demostrado que la Albúmina se "despliega" sobre la superficie de las AuNPs, existiendo al menos 12 puntos de interacción Au-tiol que contribuyen a la unión de la proteína a la NPs. Según estudios de dinámica molecular, la alta flexibilidad de la estructura de la Albúmina permite cambios significativos en su superficie (Wang, et al., 2013). Por lo tanto, además del efecto de intercambio de proteínas, las AuNPs recubiertas con una monocapa de Albúmina (MNPs) expondrán una topografía diferente al medio, con la consiguiente pérdida de la conformación nativa de la proteína (ver Figura 1). En este punto, es importante remarcar la importancia fundamental del plegamiento proteico en la funcionalidad biológica de las mismas (en este caso, las interacciones proteína-proteína). Si una proteína no se pliega correctamente o no se mantiene plegada de la manera correcta, dará lugar al mal funcionamiento de la misma en los sistemas vivos y, por lo tanto, producirá trastornos biológicos (Dobson, 2003).
Basado en toda esta evidencia científica, desarrollé mi trabajo de tesis doctoral sobre el recubrimiento de AuNPs con una multicapa estable de Albúminas, como estrategia para producir una cubierta proteica altamente compacta que preserve la estructura nativa de las Albúminas en la/s capa/s más externa/s de la nanoconstrucción (Achilli, 2019).
Para llegar a este objetivo se desarrolló una nueva metodología de preparación de NPs de Albúmina y NPs biohíbridas (oro/Albúmina) que consta de dos etapas. En primer lugar, se induce la formación de agregados proteicos reversibles de un diámetro menor a 50 nm, manteniendo la temperatura < 5 °C para conservar la conformación nativa de la Albúmina. Posteriormente, estos agregados son irradiados a baja temperatura con rayos gamma provenientes de una fuente de 60Co. La irradiación gamma genera macroradicales proteicos que se recombinan entre sí para formar nuevos enlaces covalentes intercatenarios (Achilli, 2019; Achilli E., et al., 2019). La presencia de etanol durante la irradiación evita la formación de radicales oxidantes que degradarían la proteína y sus agregados (Achilli E., et al., 2019). De esta manera, esta tecnología permite la obtención de NPs en base a proteínas, químicamente estables y con un diámetro promedio menor a 100 nm.
La caracterización de las bioHNPs, evidenciaron una estructura tipo núcleo/carcaza, donde el núcleo metálico (formado por AuNPs) es recubierto de una multicapa de Albúmina estabilizada químicamente (Flores, Achilli, Grasselli, 2018). Según estudios de Dicroísmo Circular, las bioHNPs mostraron que la estructura secundaria y terciaria de la Albúmina es conservada mayoritariamente (Achilli, 2019; Achilli, et al., 2020). En base a estos datos, podemos suponer que una gran mayoría de las proteínas preservan su estructura nativa (como se esquematiza en la Figura 1). Por otro lado, ensayos funcionales del Efecto Corona in vitro de estas bioHNPs mostraron una muy baja adsorción inespecífica de proteínas plasmáticas (Achilli, et al., 2020), confirmando su potencialidad para utilización in vivo.
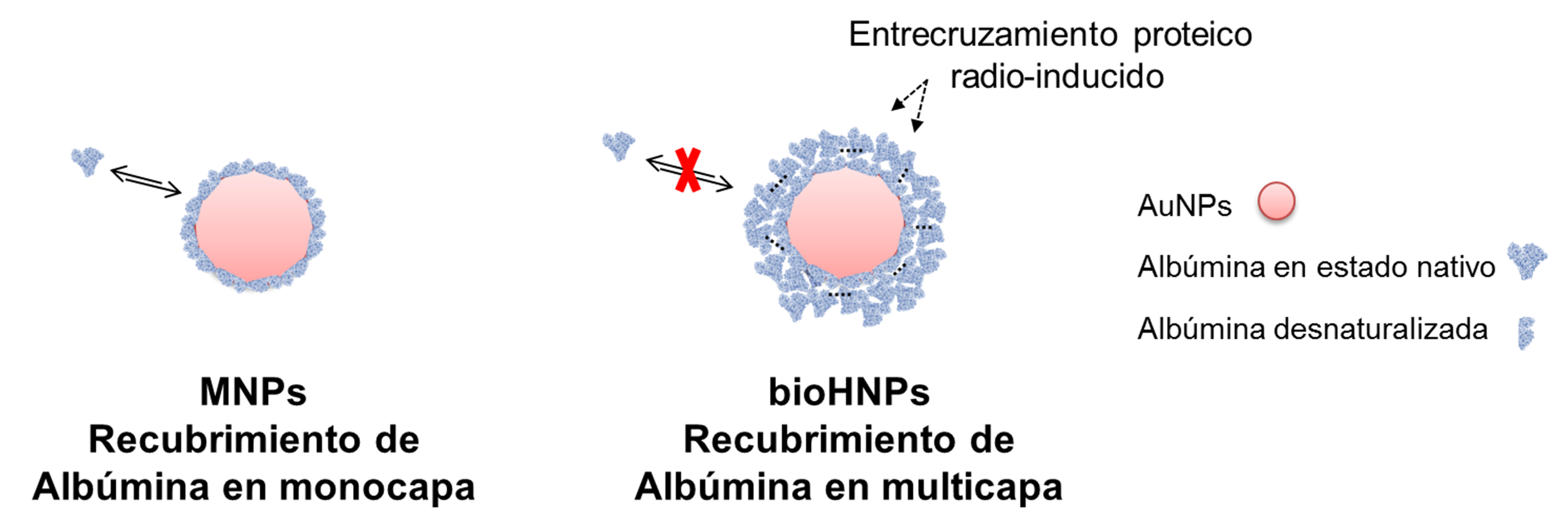
Figura 1 – Recubrimientos de AuNPs con Albúmina en forma de monocapa (mediada por interacciones débiles y con pérdida de conformación nativa de la proteína), y en forma de multicapa (estabilizadas por entrecruzamientos proteicos covalentes, con conservación de la estructura tridimensional de las Albúminas más externas).
Para analizar el potencial de estas bioHNPs para el direccionamiento específico hacia células tumorales, éstas fueron funcionalizadas con un péptido sintético (Figura 2). Actualmente, los péptidos marcados se usan para la detección in vivo de células que contienen receptores de membrana específicos para ellos (Maina, et al., 2016).
En este sentido, los ensayos de interacción de NPs con células tumorales in vitro (con receptores afines a los péptidos de direccionamiento incorporados a las NPs), en condiciones similares a la fisiológica, mostraron una muy elevada interacción con células tumorales que sobreexpresan receptores específicos, siendo prácticamente nula la interacción de las bioHNPs no funcionalizadas con el péptido de reconocimiento. Mientras tanto, en similares condiciones experimentales, se observó una interacción mínima entre las bioHNPs funcionalizadas y las células de la fracción mononuclear del plasma humano (Achilli, 2019).
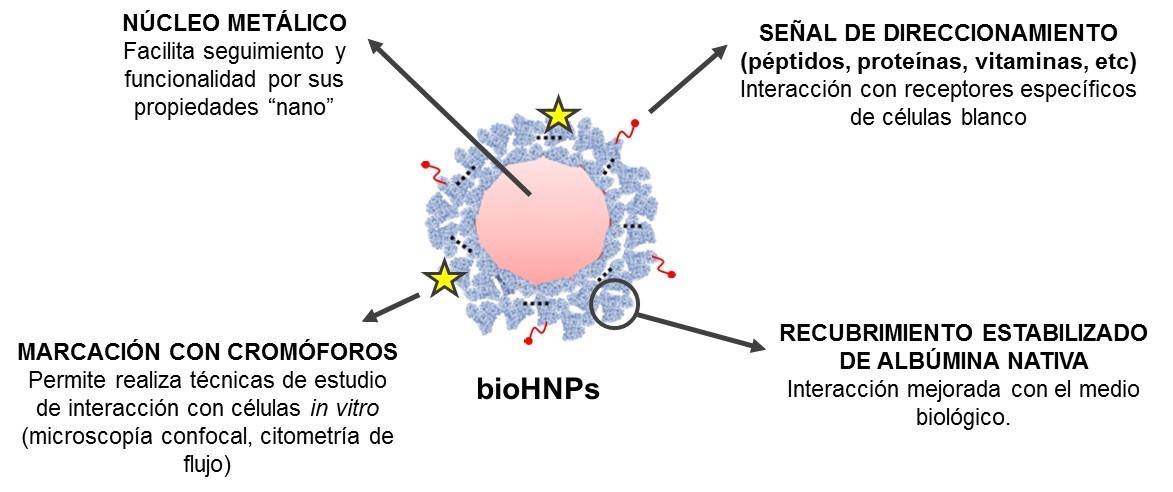
Figura 2 – NPs híbridas oro/Albúmina dotadas de una señal de direccionamiento hacia el sitio blanco de acción. Se destacan en el esquema la multifuncionalidad que posee el nanoconstructo.
Estos resultados nos permiten avanzar en las siguientes conclusiones sobre la preparación de bioHNPs. El recubrimiento en forma de multicapa de Albúmina nativa, estabilizado por uniones covalentes, permite obtener una nanoestructura con una superficie tridimensional similar a las bio-macromoléculas, como las proteínas nativas, conservando la flexibilidad molecular asociada a las mismas. Desafortunadamente, la tecnología desarrollada por el hombre no es capaz de generar nanoestructuras con este tipo de flexibilidad molecular, con lo cual se avizora que este recubrimiento con bio-macromoléculas es un camino de desarrollo tecnológicamente factible.
Otra de las ventajas del recubrimiento en forma de multicapa radica en que es factible la conservación de la estructura tridimensional de las proteínas más superficiales del mismo, mientras que en una monocapa esto no es posible. Cabe recordar que ya fue demostrado que las proteínas sufren un cambio conformacional al interactuar con la superficie altamente estructurada de las AuNPs, perdiendo parcialmente su estructura tridimensional (Wang, et al., 2013).
Las Albúminas superficiales del nanoconstructo permiten una interacción de mayor similitud a las interacciones biológicas, con otras moléculas presentes en los seres vivos, dotándolos de una identidad que les permitirá una mejor comunicación “química” con los sistemas biológicos. Esta interacción molecular tiene lugar sin intercambio de proteínas entre la multicapa de recubrimiento y las presentes en el medio, debido al entrecruzamiento covalente de la multicapa. De esta manera, cualquier señalización de direccionamiento hacia células específicas permanecerá en la superficie, permitiendo a las NPs dialogar/interactuar con las barreras biológicas.
Por otro lado, la presencia de varias señales de direccionamiento, por ejemplo un péptido de reconocimiento celular, sobre la superficie de las bioHNPs genera un fenómeno de avidez por los receptores celulares dada por la proximidad estructural. Este fenómeno permite a las bioHNPs interaccionar con las células blanco aunque éstas se encuentren en concentraciones muy bajas, del orden picomolar (Achilli, et al., 2020).
Estos nanoconstructos multifuncionales basados en Albúmina en su conformación nativa, dotados de una identidad biológica, permiten sentar las bases sobre los factores estructurales necesarios para el diseño de nanoconstructos con aplicaciones en Nanomedicina. Podemos confirmar que (i) la estabilidad química del nanoconstructo debe ser máxima, y (ii) la topografía superficial debe emular a proteína/s nativa/s, para interaccionar de manera “fisiológica” con otras macromoléculas del medio biológico. Las bioHNPs que cumplan con estas características se avizoran como muy prometedoras para el desarrollo exitoso de sistemas de diagnóstico in vivo y tratamiento de diversos tipos de cánceres.
Abadeer N.S., Murphy C.J. (2016). Recent progress in cancer thermal therapy using gold nanoparticles. The journal of physical chemistry C; 120(9), 4691-4716.
Achilli E., et al. (2015). Preparation of protein nanoparticle by dynamic aggregation and ionizing-induced crosslinking. Colloids and Surfaces A: Physicochemical and Engineering Aspects; 486, 161-171.
Achilli E. (2019). Diseño de nanopartículas proteicas con reconocimiento molecular mediante entrecruzamiento radio-inducido. Tesis doctoral, Universidad Nacional de Quilmes. http://ridaa.unq.edu.ar/handle/20.500.11807/1729.
Achilli E., et al. (2019). Radiolysis effect of the high proportion of ethanol in the preparation of albumin nanoparticle. Radiation physics and chemistry; 169, 108775.
Achilli E., et al. (2020). Enhanced gold nanoparticle-tumor cell recognition by Albumin multilayer coating. Materialia; (artículo en revision, Abril 2020).
Bor G., Mat Azmi I.D., Yaghmur A. (2019). Nanomedicines for cancer therapy: current status, challenges and future prospects. Therapeutic delivery; 10(2), 113-132.
Cedervall T., et al. (2007). Understanding the nanoparticle−protein corona using methods to quantify exchange rates and affinities of proteins for nanoparticles. PNAS; 104(7), 2050−2055.
Cui L., Her S., Borst, G.R., Bristow R.G., Jaffray D.A., Allen C. (2017). Radiosensitization by gold nanoparticles: Will they ever make it to the clinic?. Radiotherapy and oncology; 124(3), 344-356.
Damalakiene L., Karabanovas V., Bagdonas S., Valius M., Rotomskis R. (2013). Intracellular distribution of non-targeted quantum dots after natural uptake and microinjection. International journal of nanomedicine; 8, 555-568.
Dhar S., Daniel W.L., Giljohann D.A., Mirkin C.A., Lippard S.J. (2009). Polyvalent oligonucleotide gold nanoparticle conjugates as delivery vehicles for platinum (IV) warheads. Journal of the american chemical society; 131(41), 14652-14653.
Dobson C.M. (2003). Protein folding and misfolding. Nature; 426, 884-890.
Flores C.Y., Achilli E., Grasselli M. (2018). Radiation-induced preparation of core/shell gold/albumin nanoparticles. Radiation physics and chemistry; 142, 60-64.
Ghosh P., Han G., De M., Kim C.K., Rotello V.M. (2008). Gold nanoparticles in delivery applications. Advanced drug delivery reviews; 60(11), 1307-1315.
Green M.R., et al. (2006). Abraxane®, a novel Cremophor®-free, albumin-bound particle form of paclitaxel for the treatment of advanced non-small-cell lung cancer. Annual of oncology; 17(8), 1263-1268.
Gupta G.P., Massagué J. (2006). Cancer metastasis: building a framework. Cell; 127(4), 679-695.
Hainfeld J.F., Smilowitz H.M., O’Connor M.J., Dilmanian F.A., Slatkin D.N. (2013). Gold nanoparticle imaging and radiotherapy of brain tumors in mice. Nanomedicine; 8(10), 1601-1609.
Herrera L.P., Champion J.A. (2015). Protein nanoparticles for therapeutic protein delivery. Biomaterials science; 3(6), 787-799.
Hoshyar N., Gray S., Han H., Bao G. (2016). The effect of nanoparticle size on in vivo pharmacokinetics and cellular interaction. Nanomedicine; 11(6), 673–692.
Huang X., Jain P.K., El-Sayed I.H., El-Sayed M.A. (2007). Gold nanoparticles: interesting optical properties and recent applications in cancer diagnostics and therapy. Nanomedicine; 2(5), 681-693.
Instituto Nacional del Cáncer: Estadística - Mortalidad. Recuperado (Marzo 2020), https://www.argentina.gob.ar/salud/instituto-nacional-del-cancer/estadisticas/incidencia.
Ke P.C., Lin S., Parak W.J., Davis T.P., Caruso F. (2017). A decade of the protein corona. ACS nano; 11(12), 11773-11776.
Kobayashi H., Watanabe R., Choyke P.L. (2014). Improving conventional enhanced permeability and retention (EPR) effects; what is the appropriate target?. Theranostics; 4(1), 81-89.
Kong F.Y., Zhang J.W., Li R.F., Wang Z.X., Wang W.J., Wang W. (2017). Unique roles of gold nanoparticles in drug delivery, targeting and imaging applications. Molecules; 22(9), 1445.
Lee Y.K., Choi E.J., Webster T.J., Kim S.H., Khang D. (2014). Effect of the protein corona on nanoparticles for modulating cytotoxicity and immunotoxicity. International journal of nanomedicine; 10: 97–113.
Lundqvist M., Stigler J., Elia G., Lynch I., Cedervall T., Dawson K.A. (2008). Nanoparticle size and surface properties determine the protein corona with possible implications for biological impacts. PNAS; 105(38), 14265-14270.
Nie X., Chen C. (2012). Au nanostructures: an emerging prospect in cancer theranostics. Science China life sciences; 55(10), 872-883.
Maina T., et al. (2016). Preclinical and first clinical experience with the gastrin- releasing peptide receptor-antagonist [68 Ga] SB3 and PET/CT. European journal of nuclear medicine and molecular imaging; 43(5), 964-973.
Manohar N., Reynoso F.J., Diagaradjane P., Krishnan S., Cho S.H. (2016). Quantitative imaging of gold nanoparticle distribution in a tumor-bearing mouse using benchtop x-ray fluorescence computed tomography. Scientific reports; 6, 22079.
Mieszawska A.J., Mulder W.J., Fayad Z.A., Cormode D.P. (2013). Multifunctional gold nanoparticles for diagnosis and therapy of disease. Molecular pharmaceutics; 10(3), 831-847.
Moghimi S.M., Hunter A.C., Murray J.C. (2005). Nanomedicine: current status and future prospects. The FASEB journal; 19(3), 311-330.
Mohammadi M.R., Corbo C., Molinaro R., Lakey J.R.T. (2019). Biohybrid Nanoparticles to negotiate with biological barriers. Small; 15, 1902333.
Organización Mundial de la Salud: Cáncer (Septiembre 2018). Recuperado (Marzo 2020), https://www.who.int/es/news-room/fact-sheets/detail/cancer.
Ogawara K.I., et al. (2004). Pre-coating with serum albumin reduces receptor-mediated hepatic disposition of polystyrene nanosphere: implications for rational design of nanoparticles. Journal of controlled release; 100(3), 451-455.
Polo E., Collado M., Pelaz B., Del Pino P. (2017). Advances toward more efficient targeted delivery of nanoparticles in vivo: understanding interactions between nanoparticles and cells. ACS nano; 11(3), 2397-2402.
Pugazhendhi A., Edison T.N.J.I., Karuppusamy I., Kathirvel B. (2018). Inorganic nanoparticles: a potential cancer therapy for human welfare. International journal of pharmaceutics; 539(1-2), 104-111.
Rand D., et al. (2011). Nanomaterials for X-ray imaging: gold nanoparticle enhancement of X-ray scatter imaging of hepatocellular carcinoma. Nano letters; 11(7), 2678-2683.
Rosi N.L., Giljohann D.A., Thaxton C.S., Lytton-Jean A.K., Han M.S., Mirkin C.A. (2006). Oligonucleotide-modified gold nanoparticles for intracellular gene regulation. Science, 312(5776), 1027-1030.
Saha K., Agasti S.S., Kim C., Li X., Rotello V.M. (2012). Gold nanoparticles in chemical and biological sensing. Chemical reviews; 112(5), 2739-2779.
Samadian H., Hosseini-Nami S., Kamrava S.K., Ghaznavi H., Shakeri-Zadeh A. (2016). Folate-conjugated gold nanoparticle as a new nanoplatform for targeted cancer therapy. Journal of cancer research and clinical oncology; 142(11), 2217-2229.
Shakeri-Zadeh A., Mansoori G.A., Hashemian A.R., Eshghi H., Sazgarnia A., Montazerabadi A.R. (2010). Cancerous cells targeting and destruction using folate conjugated gold nanoparticles. Dynamic Biochemistry, process biotechnology and molecular biology; 4, 06-12.
Shin T.H., Choi Y., Kim S., Cheon J. (2015). Recent advances in magnetic nanoparticle-based multi-modal imaging. Chemical society reviews; 44(14), 4501-4516.
Siegel R.L., Miller, K.D., Jemal, A. (2019). Cancer statistics, 2019. CA: a cancer journal for clinicians; 69(1), 7-34.
Siri M., Achilli E., Grasselli M., Alonso S.delV. (2017). Albumin nanocarriers, γ-irradiated crosslinked, combined with therapeutic drugs for cancer therapy. Current Pharmaceutical Design; 23(35), 5272-5282.
Soto Espinoza S.L., Sánchez M.L., Risso V., Smolko, E.E., Grasselli M. (2012). Radiation synthesis of seroalbumin nanoparticles. Radiation physics and chemistry; 81(9), 1417-1421.
Sun L., Liu D., Wang Z. (2008). Functional gold nanoparticle−peptide complexes as cell-targeting agents. Langmuir; 24(18), 10293-10297.
Van der Meel R., Lammers T., Hennink W.E. (2017). Cancer nanomedicines: oversold or underappreciated?. Expert opinion on drug delivery; 14(1), 1-5.
Van't Veer L.J., et al. (2002). Gene expression profiling predicts clinical outcome of breast cancer. Nature; 415(6871), 530-536.
Velasco-Aguirre C., et al. (2015). Peptides and proteins used to enhance gold nanoparticle delivery to the brain: preclinical approaches. International journal of nanomedicina; 10, 4919–4936.
Verma A., Stellacci F. (2010). Verma and Stellacci, 2010. Effect of surface properties on nanoparticle-cell interactions. Small;6(1), 12-21.
Wang L., et al. (2013). Revealing the binding structure of the protein corona on gold nanorods using synchrotron radiation-based techniques: understanding the reduced damage in cell membranes. Journal of the american chemical society; 135, 17359–17368.
Wilhelm S., et al. (2016). Analysis of nanoparticle delivery to tumours. Nature reviews materials; 1(5), 16014.
Yang D.P., et al. (2017). Unexpected formation of gold nanoflowers by a green synthesis method as agents for a safe and effective photothermal therapy. Nanoscale; 9(41), 15753-15759.
Yang P.H., Sun X., Chiu J.F., Sun H., He Q.Y. (2005). Transferrin-mediated gold nanoparticle cellular uptake. Bioconjugate chemistry; 16, 494-496.
Zhao F., Zhao Y., Liu Y., Chang X., Chen C., Zhao Y. (2011). Cellular uptake, intracellular trafficking, and cytotoxicity of nanomaterials. Small; 7(10), 1322-1337.
Zhu L., Zhou Z., Mao H., Yang L. (2017). Magnetic nanoparticles for precision oncology: theranostic magnetic iron oxide nanoparticles for image-guided and targeted cancer therapy. Nanomedicine; 12(1), 73-87.

