Potencial tecnológico de la cepa autóctona de Oenococcus oeni UNQOe19 para su empleo como iniciador maloláctico
Technological potential of the Oenococcus oeni UNQOe19 indigenous strain for use as a malolactic fermentation starter
Bárbara Bravo Ferrada Danay Valdes La Hens Elizabeth Naiquen Flores Elizabeth Tymczyszy Liliana Semorile Marina Navarro Natalia BrizuelaLa elaboración de vinos consta principalmente de dos procesos, la fermentación alcohólica (FA), realizada por levaduras y la fermentación maloláctica (FML) guiada por las bacterias ácido lácticas (BAL). Durante la FML el metabolismo de las BAL produce la descarboxilación del ácido L-málico a ácido láctico y dióxido de carbono. Esto disminuye la acidez percibida, contribuye a la estabilidad microbiana y modifica positivamente el perfil aromático del vino. Durante el proceso de vinificación la FML puede ocurrir de forma incompleta y deficiente produciendo resultados indeseables cuando ocurre de manera espontánea por acción de las BAL nativas. Actualmente la mayoría de las bodegas de la región patagónica elaboran sus vinos mediante fermentación espontánea conducida por las BAL presentes en las uvas y bodegas o utilizan iniciadores (starters) malolácticos comerciales formulados con BAL para asegurar una FML exitosa. En Argentina los starters malolácticos comerciales son importados y formulados con cepas de BAL provenientes de otras regiones vitivinícolas del mundo. Al considerar el aporte sensorial de las BAL durante la elaboración del vino, el uso de BAL foráneas atentaría contra la tipicidad del terruño. Por este motivo resulta estratégico disponer de cultivos iniciadores malolácticos nativos de las BAL mejor adaptadas a las características agroecológicas de los cultivares locales con mayor capacidad de competencia frente a la microbiota salvaje, permitiendo obtener vinos de calidad y conservar las características del terroir regional.
Los starters malolácticos se definen como preparaciones que contienen una o más cepas pertenecientes a una misma o diferentes especies de BAL, las cuales son inoculadas en el vino durante o después de la FA con el objetivo de conducir exitosamente la FML (Henick-Kling, 1995; Krieger-Weber, 2009). Este procedimiento reduce los riesgos asociados a una FML espontánea, que implica la presencia de microorganismos indeseados capaces de producir efectos deteriorantes, tales como la formación de aminas biogénicas, el retraso o detención de la fermentación y la presencia de bacteriófagos (Lerm, Engelbrecht & du Toit, 2010). La inoculación del vino con starters malolácticos formulados con BAL seleccionadas por sus propiedades tecnológicas y enológicas, aisladas de FML espontáneas de la propia región vitícola, garantiza la implantación y el rápido inicio de este proceso, así como un mejor control sobre la producción de compuestos aromáticos del vino (Bauer & Dicks, 2004), mejorando la calidad de los vinos y preservando las características sensoriales distintivas de la región.
Los criterios utilizados para seleccionar cepas de BAL con uso potencial como iniciadores malolácticos se relacionan con las propiedades tecnológicas de las mismas y se refieren a: I) la tolerancia a las condiciones estresantes del vino durante la FML (bajo pH, elevadas concentraciones de etanol y sulfito y resistencia a bacteriófagos específicos) (Guzzo et al. 2000; Spano & Massa, 2006; Alexandre, Costello, Remize, Guzzo & Guilloux‐Benatier, 2004). II) la resistencia a la conservación mediante liofilización y congelación (Alexandre et al. 2004; G-Alegría et al. 2004). III) lno deben producir compuestos indeseables, tales como aminas biogénicas o etilcarbamato (Fiocco, Capozzi, Goffin, Hols & Spano, 2007). IV) la modificación del perfil sensorial del vino aportando aromas y sabores distintivos, color y textura entre otras propiedades enológicas deseables (Brizuela, 2019). Para que las BAL puedan sobrevivir a la re-introducción en el vino deberán someterse a un proceso de aclimatación. Los enólogos elaboran sus propios medios de aclimatación con, jugo de uva o de manzana complementado con otros nutrientes, tales como extracto de levadura, peptona y Tween 80 (Pilone & Kunkee, 1972; Kunkee, 1974; Costello, Morrison, Lee & Flee, 1983; Henick-Kling, 1993). En otros casos se preparan cultivos iniciadores en vino diluido, debido a la reducción del riesgo de contaminación microbiana y para lograr una mayor tolerancia de las BAL al etanol (Hayman & Monk, 1982; Nault, Gerbaux, Larpent, & Vayssier, 1995). La aclimatación mediante la pre-exposición de las BAL a condiciones sub-letales de estrés, como etanol y bajo pH, tiene un efecto positivo sobre su supervivencia al momento de ser inoculadas en el vino (Bourdineaud et al. 2003; Bravo-Ferrada, Tymczyszyn, Gómez-Zavaglia & Semorile, 2014; Bravo-Ferrada et al. 2016).
Además, el uso de BAL como cultivos iniciadores en la industria vitivinícola implica la producción de biomasa y su posterior preservación garantizando así la estabilidad de los cultivos en cuanto a su viabilidad y funcionalidad a largo plazo (Carvalho et al. 2023). Por lo tanto, se requiere obtener concentrados de BAL viables en formato seco, con capacidad enológica y tecnológica eficiente. El proceso de deshidratación reduce la actividad de agua e inhibe las reacciones de deterioro celular, sin embargo, puede ocurrir pérdida de la viabilidad generada por el daño a la membrana plasmática (Santivarangkna, Higl & Foerst, 2008; Wang, Pu, Yu, Xia & Ai, 2020). Para minimizar este daño, se añaden agentes protectores como azúcares y aminoácidos que tienen grupos amino o hidroxilo capaces de reemplazar el agua en las macromoléculas. Esta sustitución de moléculas de agua protege las proteínas y las membranas lipídicas durante la conservación y, por lo tanto, mejora la recuperación célula. El éxito del proceso de preservación depende de la correcta elección del agente protector, las condiciones de deshidratación, la humedad remanente, la temperatura de almacenamiento y las condiciones intrínsecas del microorganismo (Cui et al. 2018).
La obtención de biomasa de BAL requiere el diseño de un medio de cultivo alternativo, debido a que los medios de cultivo comerciales son de elevado costo (Brizuela et al. 2021). En este contexto, el reciclaje de subproductos de la industria alimentaria constituye una alternativa económica y sostenible que cumple con el concepto de economía circular (Fidelis et al. 2019). Por otro lado, las BAL son nutricionalmente exigentes por lo cual, los subproductos deben ser suplementados con péptidos, extracto de levadura, magnesio, manganeso y tween, esenciales para la síntesis de ácidos nucleicos, fosfolípidos y ATP; y el tween proporciona ácidos grasos esenciales (Saeed & Salam, 2013).
O. oeni UNQOe19 es una cepa psicrótrofa nativa aislada de la FML espontánea de un vino Pinot noir que proviene de una bodega comercial de General Roca (Rio Negro) de más de 100 años de antigüedad. Esta cepa fue seleccionada por su capacidad de implantación en presencia de la microbiota nativa del vino y por conducir exitosamente la FML a temperaturas de 4, 10 y 21 °C (Manera et al., 2019). El análisis in silico del genoma completo de UNQOe19 (CP027431) permitió detectar genes que codifican para enzimas implicadas en la síntesis de metabolitos de interés enológico y reveló diversidad metabólica mediante la presencia de rutas como glucolisis, pentosa fosfato, galactosa, almidón y sacarosa permitiéndole metabolizar diversos tipos de hidratos de carbono. Debido a esta predicción, fueron seleccionados el Bagazo de Manzana (BM), y el Permeado de Suero (PS) como sustratos alternativos para optimizar la obtención de biomasa.
El bagazo de manzana (BM), obtenido de la fabricación de jugo de manzana posee numerosas ventajas como material primario para la elaboración de medios alternativos (Gullón, Garrote, Alonso & Parajó,2007b). Ha sido empleado con éxito para crecer levaduras de interés enológico autóctonas (Bravo et al., 2016; Bravo, Morales, del Mónaco & Caballero, 2019) y para cultivar BAL con resultados promisorios (Cerdeira et al., 2021). El permeado de suero (PS) resultante de la elaboración de quesos, se aprovecha por ser rico en lactosa y sales minerales. Esto ha permitido producir biomasa de BAL con fines probióticos y otros metabolitos, como ácido láctico y galacto-oligosacáridos (Golowczyc et al, 2013; Hugo, Bruno & Golowczyc, 2016). Trabajos previos demostraron que Lpb. plantarum puede crecer y deshidratarse, por liofilización (Brizuela et al., 2021) o secado spray, en medios formulados con permeado de suero, sin agregado de suplementos nutricionales (Golowczyc et al., 2013; Cerdeira, Bravo-Ferrada, Semorile, & Tymczyszyn, 2019). Sin embargo, al día de hoy no se ha reportado el crecimiento de O. oeni de interés enológico en medio alternativo formulado con permeado de suero de leche.
En este trabajo se plantean como objetivos, evaluar el crecimiento de la cepa UNQOe19 de O. oeni en medios alternativos formulados con los subproductos de la industria alimenticia bagazo de manzana y permeado de suero leche. En segundo lugar, determinar las propiedades tecnológicas de la cepa UNQOe19 de O. oeni mediante el estudio de la tolerancia a diferentes condiciones de pH, alcohol, sulfitos, lisozimas y preservación por liofilización.
2.1 Bacteria ácido láctico empleada
La cepa psicrótrofa de O. oeni UNQOe19 fue aislada de la FML espontánea de un vino Pinot noir (vendimia 2014) producido en una bodega comercial de General Roca, Patagonia Norte, Argentina. El vino presentó al final de la FA valores de 14.3% v / v de etanol, pH 3.7 y concentración de 2.3 g/L de ácido L-málico.
2.2 Medios de cultivo alternativos
Los medios de cultivos alternativos fueron formulados con subproductos de la elaboración de jugo de manzana (Empresa Jugos S.A., Villa Regina Rio Negro, Argentina) y de quesos (Arla Foods Ingredients S.A., Buenos Aires, Argentina), tales como el bagazo de manzana (BM) y permeado de suero (PS) respectivamente. El BM (con una concentración del 50% p/v) contenía la siguiente composición: 80% humedad, 21% p/p sólidos totales, 10% p/p azúcares reductores, 120 mg N/kg nitrógeno fácilmente asimilable (FAN), 1700 polifenoles totales, 16,62g/L Glucosa/Fructosa, 1,22 mg/L ácido málico. Se evaluó el crecimiento de UNQOe19 en BM suplementado con sales y extracto de levadura empleando las siguientes combinaciones: I) Extracto de levadura (EL) 1% disuelto en solución fisiológica en una relación 1:1; II) Solución de sales de manganeso, magnesio, cisteína y Tween 80 (relación 1:1); III) EL 1 % disuelto en solución de sales (II).
El PS contenía la siguiente composición, lactosa 80% p/p, cenizas 6% p/p y proteínas 3% p/p. Para el crecimiento de UNQOe19, el PS también se suplementó con sales y extracto de levadura combinándose de la siguiente manera: I) EL 1% disuelto en solución fisiológica (1:1); II) Solución de sales de manganeso, magnesio y Tween 80; III) EL 1 % disuelto en solución de sales (II).
Como control de crecimiento en condiciones óptimas para la cepa UNQOe19 se utilizó el medio comercial MLO: Triptona 10,0 g/L, extracto de levadura 5,0 g/L, D (+) glucosa 10,0 g/L, fructosa 5,0 g/L, Tween 80 1ml, citrato ácido de amonio 3,5 g/L, Mg2SO4 7H2O 0,2 g/L, Mn2SO4 4H2O 0,05 g/L, cisteína 0,5 g/L, jugo de tomate 100 mL/L pH: 4,5 (Biokar Diagnostics, Ref BK070HA, Lot 0001199).
Los medios de cultivo alternativos suplementados y el MLO comercial utilizados en este ensayo fueron esterilizados en autoclave a 121°C, 1atm durante 15 minutos.
2.3 Evaluación de la viabilidad de UNQOe19 en medios alternativos de cultivo
Previo a la inoculación se verificó la pureza de UNQOe19 por observación de la morfología de la colonia en agar MLO, prueba de catalasa y por microscopía óptica mediante tinción de Gram.
La concentración del inóculo inicial fue determinada mediante inoculación en 10ml de medio comercial MLO (Maicas, González-Cabo, Ferrer & Pardo, 1999) e incubación a 28°C durante cinco días. Las UFC fueron determinadas mediante recuento en agar MLO usando el método de la gota (Corral-Lugo et al. 2012). Para esto se tomó 100μl de muestra de cultivo y se diluyó seis veces de forma seriada en solución fisiológica estéril, luego se sembraron gotas de 5μl. Las placas se incubaron a 28 °C durante 72h y los resultados se informaron como UFC/ml.
Posteriormente se inocularon 107 UFC/mL de la cepa UNQOe19 en 20 g de medio formulado con BM y l05 UFC/mL en PS al 5% para cada condición: I, II, III y en el medio control MLO. Los cultivos fueron incubados por 28 días a 28 °C en condición estática. La viabilidad de UNQOe19 en las distintas formulaciones de cultivo fue monitoreada mediante recuento por el método de la gota en agar MLO a distintos tiempos (0,1, 4, 10, 12, 15 y 27 días del BM; 0, 2, 4, 7, 9, 11, 14, 16 y 18 días del PS).
2.4 Evaluación cualitativa de la capacidad de degradación de UNQOe19 durante su crecimiento en el bagazo de manzana.
Se realizó la comparación de cambios en la textura del BM al día 0 y día 28 de cultivo. Se evaluó la capacidad de UNQOe19 para degradar polímeros de hidrato de carbono comparando muestras de BM al inicio y final del ensayo las cuales fueron teñidas con reactivo de Lugol (diluido 1/10) y observadas en el microscopio óptico 40x.
2.5 Evaluación de las propiedades tecnológicas de UNQOe19
Para evaluar la tolerancia de UNQOe19 a las condiciones estresantes del vino, la cepa fue expuesta a diferentes condiciones de pH, etanol, sulfitos y lisozimas. Para esto se inoculó en el medio comercial MLO, modificado según las siguientes condiciones: I) suplementado con lisozimas (100, 250 y 500 ppm); II) ajuste de pH desde 3,5 a 3,8; III) concentraciones de etanol del 10 % y 14 %; IV) niveles variables de SO2 molecular (0,25, 1,25 y 2,5 mg/L) en MLO a pH=3,5; V) medio comercial MLO sin suplementar como control positivo. Las condiciones fueron incubadas a 28 °C y se monitoreó la viabilidad en agar MLO por el método de la gota tomando muestras a las 0h, 48h y 120h.
Por otra parte, la tolerancia de UNQOe19 a la liofilización se determinó sobre cultivos aclimatados y sin aclimatación previa al proceso de liofilización. Para obtener un cultivo aclimatado, la cepa UNQOe19 fue cultivada en caldo MLO hasta fase estacionaria (aproximadamente 10¹0 UFC mL⁻¹); se recolectó mediante centrifugación a 4000 g durante 10 min, se resuspendió en 10 mL de medio de aclimatación formulado 50 g L⁻¹ de MRS, 40 g L⁻¹ de D(⁻¹) fructosa, 20 g L⁻¹ de D(⁻¹) glucosa, 4 g L⁻¹ de L-malato, 6 g L⁻¹ de Tween 80, 0,1 mg L⁻¹ de piridoxina y etanol al 6 % v/v (pH: 4,6) y se incubó a 21 °C durante 48 h (Bravo-Ferrada, Tymczyszyn, Gómez-Zavaglia & Semorile, 2014). El medio de aclimatación es utilizado para acondicionar las BAL para optimizar la supervivencia al proceso de deshidratación mediante liofilización.
El cultivo de UNQOe19 aclimatado se fraccionó en tubos Eppendorf con 1ml de cultivo cada uno. Se realizó un lavado con solución fisiológica (centrifugación a 5000 rpm, 10 minutos y 4°C); luego de descartar el sobrenadante, el pellet se resuspendió en 200μl de crio-conservante disuelto en Buffer fosfato a pH= 7; los crio-conservantes utilizados fueron maltodextrina y trehalosa al 20% (cinco tubos Eppendorf para cada uno). Los tubos Eppendorf quedaron destapados y solo se cubrieron con papel Parafilm conservándose a -80°C durante tres meses y posteriormente se perforó el Paraflim y las muestras se deshidrataron por liofilización (BIOBASE freeze dryer system/BK-FD10P, Shandong, China) durante 24h (temperatura del condensador: -60 °C; presión de la cámara: 10 Pa). Finalizada la liofilización, las muestras fueron selladas al vacío y se conservaron a 10 °C hasta su utilización.
La tolerancia al proceso de liofilización se evaluó mediante la rehidratación de los cultivos deshidratados durante 1 hora en caldo MLO y posterior determinación de viables en agar MLO. Se comparó la viabilidad con la del inóculo inicial (tomado antes de liofilizar). Se realizó el mismo procedimiento con la cepa UNQLp11 de Lpb. plantarum control positivo de liofilización.
Análisis estadístico
Todos los ensayos fueron realizados por triplicado utilizando cultivos independientes. Para el análisis estadístico se utilizó el programa GraphPad Prism versión 8.02, mediante ANOVA (Analysis of Variance), y posterior test de Tukey o Dunett según corresponda. Los resultados son expresados con la media ± su desvío estándar y las diferencias se consideran significativas cuando P<0.05.
3.1 Crecimiento de UNQOe19 en medios de cultivo alternativos
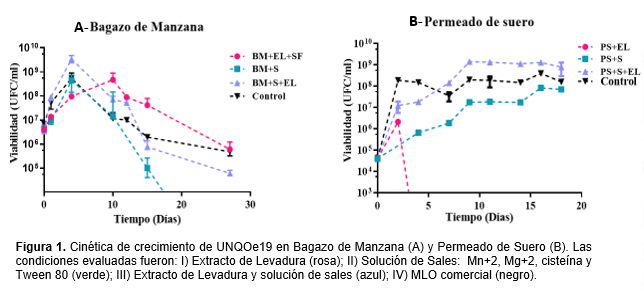
La cepa UNQOe19 mostró capacidad de crecimiento tanto en BM como en PS y, en ambos casos, los mayores valores de viabilidad fueron detectados en los cultivos suplementados con la condición de agregado de extracto de levadura y la solución de sales a tiempos variables (figura 1). En el caso del BM la cinética reveló un rápido incremento de biomasa a los 5 días alcanzando valores de viabilidad en un orden de 1010 UFC/ml, un orden mayor que el detectado para el crecimiento en medio comercial MLO al mismo tiempo. Inclusive durante la etapa de decrecimiento a partir de este tiempo para esta condición, el valor de viables siguió siendo mayor al control hasta los 15 días analizados.
Por otra parte, la cinética de UNQOe19 en PS suplementado con extracto de levadura y sales mostró valores de viabilidad mayores al control a partir del día 7, alcanzando valores máximos de viabilidad del orden de 109 UFC/ml manteniéndose constante a partir del día 10 hasta finalizar el ensayo. La condición formulada con extracto de levadura no fue favorable para el crecimiento de UNQOe19.
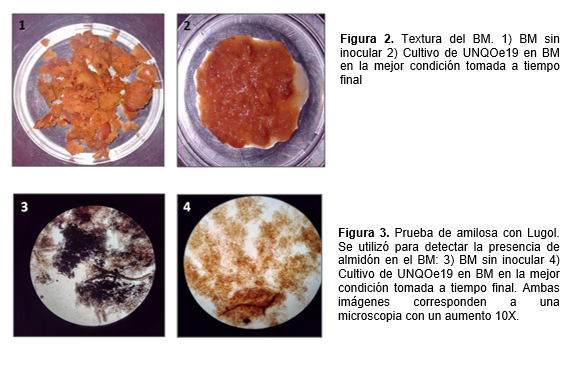
Se observó la textura del BM (figura 2) previo a la inoculación con UNQOe19 (1) y a tiempo final (2). El BM previo a la inoculación mostró una textura heterogénea compuesta por semillas y material del parénquima vegetal de aproximadamente 1 cm de diámetro (figura 2.1). Posterior a la incubación con la cepa UNQOe19 se detectó degradación del sustrato, desaparición de las semillas, cambio de textura en forma de sustrato triturado (figura 2.2) y un aroma similar a la compota de manzana. También se apreciaron cambios en las muestras teñidas con Lugol (figura 3) en donde se observó color violeta intenso en el BM sin inóculo que podría indicar la reacción con almidón vegetal (3) mientras que en el cultivo a tiempo final la intensidad del color disminuyó notablemente indicando desaparición de polímeros de hidrato de carbono en forma de almidón como resultado de la posible actividad amilasa (4). Estas diferencias al inicio y final del ensayo sugieren la liberación de enzimas de UNQOe19 que le permitieron metabolizar la matriz sólida del BM. La caracterización de enzimas degradativas en UNQOe19 resulta de interés y será evaluada a futuro.
3.2 Tolerancia a las condiciones estresantes del vino
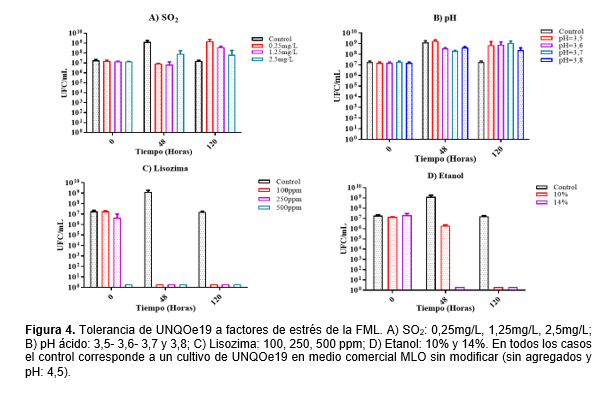
Los resultados de la evaluación de tolerancia a las condiciones estresantes del vino y del proceso de vinificación expusieron que UNQOe19 presentó resistencia a las diferentes concentraciones utilizadas de SO2 y mostró valores de viabilidad en un rango de 107-109 UFC/mL (figura 4-A). Se detectaron variaciones en la tolerancia a las diferentes concentraciones de SO2 a 48h y 120 h. A las 48h mostró en todas las condiciones menor viabilidad que el control sin SO2. Sin embargo, a las 120h mostró mayor viabilidad que el control sin agregado de SO2. También se identificó a las 120h un incremento de la viabilidad a menores concentraciones de SO2, obteniendo mejores resultados a 0,25mg/L. La tolerancia a la presencia de SO2 es crucial debido a que este es agregado como antimicrobiano en los pasos iniciales del proceso de vinificación.
En la evaluación de la tolerancia a diferentes pHs, según indica la figura 4-B no se hallaron variaciones significativas en la viabilidad. La cepa UNQOe19 mostró tolerancia a los valores de pHs ácidos propios del vino, permitiéndole mantenerse viable y superar los valores de viabilidad detectados en el control a tiempo final.
El agregado de lisozima es otra práctica que se utiliza en algunas bodegas para controlar la presencia de microorganismos deteriorantes. UNQOe19 no reveló viabilidad en el MLO suplementado con lisozimas (figura 4-C) por lo que se deberá evaluar nuevas técnicas de adaptación antes de inocular en condiciones de lisozimas.
La concentración de etanol después de la FA puede alcanzar valores de hasta el 14 %; la cepa UNQOe19 mostró tolerancia a etanol al 10% a las 48h (figura 4-D).
3.3 Resistencia a la preservación por liofilización
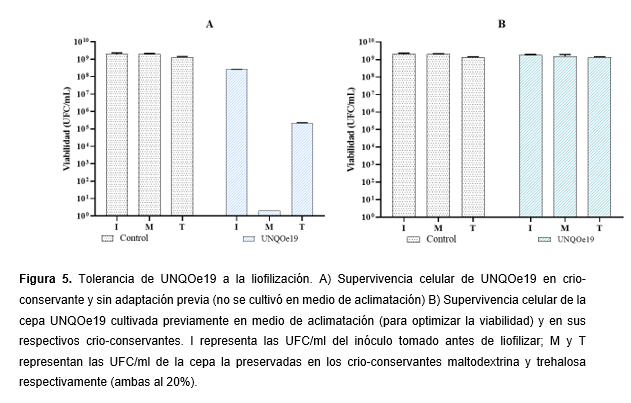
Los resultados de liofilización se interpretaron en comparación a la viabilidad de la cepa UNQOe19 (UFC/ml) preservada en maltodextrina (M) y trehalosa (T) con respecto al inóculo utilizado inicialmente (I). La figura 5-A corresponde a la supervivencia celular de UNQOe19 sin ningún tratamiento previo de aclimatación y la figura 5-B muestra los resultados de preservación con el cultivo aclimatado previamente. En los cultivos sin aclimatar se observó que la preservación fue más efectiva cuando se utilizó T como crio-conservante, donde la viabilidad descendió dos órdenes con respecto a I, mientras que en M no se observó crecimiento. En la figura 5-B, donde la cepa de UNQOe19 se trató previamente en el medio de aclimatación se detectaron valores de viabilidad en M y T que igualan a I. Estos resultados fueron similares a los detectados para la cepa UNQLp11 de Lpb. plantarum usada como control de preservación. El tratamiento de aclimatación demostró facilitar la adaptación de la cepa UNQOe19 al tratamiento de deshidratación por liofilización.
Los resultados obtenidos demuestran la eficiencia del BM y PS como medios de cultivos alternativos de UNQOe19 de O. oeni para la futura elaboración de iniciadores malolácticos autóctonos. La predicción realizada en trabajos previos a través del análisis de las rutas KEEG (Flores, 2022) y la cinética de crecimiento observada en tales sustratos permite el diseño de un medio de cultivo basado en sustratos alternativos para la obtención de biomasa de UNQOe19 a mayor escala.
O. oeni UNQOe19 creció con éxito en los dos sustratos alternativos detallados bajo la utilización de formulaciones diferentes y tomando como referencia al medio comercial MLO. En términos generales, para ambos tipos de sustratos se emplearon los mismos suplementos: I) Extracto de levadura; II) Solución de sales; III) Extracto de levadura y solución sales. Sin embargo, para ambos sustratos la cinética de crecimiento difirió considerablemente. Este comportamiento se atribuye a la diferencia que hay entre los medios de cultivo alternativos en cuanto al estado de agregación, matriz y composición de cada uno. En el caso de BM se observó una caída sostenida de la viabilidad a partir de los 10 días de cultivo, sin embargo, en el caso de las cinéticas del PS de observó una fase estacionaria que comienza a los 10 días de cultivo y se mantiene hasta los 20 días analizados. Estos estudios preliminares de optimización del crecimiento en subproductos provenientes de la producción de alimentos para obtener cultivos de UNQOe19, nos dan los primeros datos para el diseño de medios de cultivo alternativos que reemplacen los medios comerciales.
En particular, el cultivo con BM representó un desafío por ser un cultivo en base sólida y con una matriz nutricionalmente compleja, por lo que para evaluar el crecimiento de UNQOe19 en BM por un tiempo prolongado se inoculó un número mayor de bacterias (107 UFC/ml) previendo posibles efectos desfavorables sobre la cepa. A futuro se ensayarán concentraciones iniciales mínimas para evaluar el comportamiento cinético. La cinética de UNQOe19 en BM describió un crecimiento exponencial acelerado durante los primeros días de cultivo alcanzando la máxima viabilidad a los 5 días de cultivo. Mientras que en la cinética obtenida en PS (a excepción de la condición, suplementada con levadura) se observó un crecimiento exponencial lento hasta alcanzar valores máximos de viabilidad al día 10 de cultivo, estos resultados permitirán diseñar nuevas estrategias de cultivo para estas condiciones.
Con respecto a las tres condiciones evaluadas en BM, la combinación con extracto de levadura y sales resultó ser la mejor formulación ensayada si se tiene en cuenta que los valores de viabilidad obtenidos superaron a los del control en el medio comercial durante los primeros 5 días de incubación. Debido a la cinética obtenida correspondiente al cultivo suplementado con extracto de levadura (condición I), el crecimiento de O. oeni UNQOe19 requiere adicionalmente un ajuste con sales. Esto sugiere que las sales podrían actuar como cofactores de enzimas hidrolíticas presentes en la cepa o bien de transportadores que faciliten el ingreso de moléculas para su metabolismo aprovechando los componentes de este sustrato para poder crecer. La suplementación con extracto de levadura y sales tanto para el PS como para el BM resultó ser la combinación óptima ensayada hasta el momento para obtener biomasa de la cepa de O. oeni UNQOe19. El crecimiento de una cepa de O. oeni en permeado de suero suplementado resulta novedoso porque hasta el momento no se han reportado crecimientos exitosos de cepas de O. oeni en este sustrato.
El BM contiene hasta un 22% de hidratos de carbono (Shalini, Gupta & Singh, 2009) incluyendo macromoléculas como celulosa, hemicelulosa y lignina y también por azúcares simples como la glucosa, fructosa y sacarosa (Vendruscolo, Albuquerque, Streit, Esposito & Ninow, 2008). También contiene protopectina (precursor de pectina) (Lu & Foo, 1997, 2000; Schieber et al. 2003; Vendruscolo et al. 2008). El uso de lugol permite detectar polímeros de polisacáridos, mayormente de almidón; el iodo se introduce entre las espiras de la molécula de almidón formando un compuesto de inclusión de coloración azul-violeta. Esto explicaría la coloración azul-violeta en el BM sin incubar y la disminución de este color en el BM al finalizar el ensayo. Esto sugiere que, durante los 27 días de cultivo, UNQOe19 fue capaz de hidrolizar las moléculas complejas de hidratos de carbono. La capacidad hidrolítica también se pudo evidenciar de forma macroscópica comparando la textura del BM antes y después de 27 días de cultivo donde se obtuvo BM totalmente degradado pasando de una textura sólida y seca a una textura mucho más húmeda y degradada. Esto sugiere que la cepa UNQOe19 produce enzimas capaces de metabolizar carbohidratos en forma de polímeros tales como, celulosa y almidón, facilitando el crecimiento en BM.
En el estudio del crecimiento de UNQOe19 en condiciones estresantes propias de la FML se evaluó su comportamiento en presencia de SO2, pH ácido, etanol y lisozimas (figura 4). Se comparó los valores de viabilidad obtenidos luego de inocular la cepa en un medio suplementado con SO2 a 0,25mg/L, 1,25mg/L y 2,5mg/L a pH=3,5, donde la primera concentración reveló los mayores valores de tolerancia. No obstante, este comportamiento es esperable ya que se ha demostrado en otros trabajos la supervivencia celular de cepas de O. oeni en loscuales no solo se ha reportado su alta resistencia al SO2 sino que también han demostrado que las bajas concentraciones de SO2 y los pH bajos estimulan ligeramente el crecimiento de la cepa (Mesas, Rodríguez, & Alegre, 2004). El SO2 es un compuesto antimicrobiano y antioxidante que se usa en el proceso de vinificación (Quirós, Herrero, García & Díaz, 2012). Su efectividad en el vino como antioxidante y antimicrobiano depende de la cantidad de dióxido de azufre molecular en solución. El porcentaje de distribución de SO2 depende del pH. El SO2 es la forma más activa en su acción antimicrobiana y en mostos con pH bajo se encuentra frecuentemente. Varios compuestos como azúcares y acetaldehído se unen al SO2 y esto lo hace menos activo que el SO2 libre (Britz & Tracey, 1990). El metabolismo de las BAL mejor adaptadas incrementa el pH del medio disminuyendo de forma indirecta la concentración real de SO2 en medio. Las BAL más tolerantes podrían expresar genes de resistencia a estrés inducidas por la presencia del inductor en este caso el SO2. El estudio del genoma completo de la cepa UNQOe19 ha mostrado la presencia de 160 genes distintivos de esta cepa en comparación con otros genomas completos de O. oeni (Iglesias, 2018) entre los que se encuentran numerosos genes de respuesta a estrés oxidativo. Además, la cepa UNQOe19 fue aislada de vinos sulfitados donde las cepas que prevalecen en el vino presentan mayor tolerancia a ciertas concentraciones de SO2 (Manera et al., 2019, Bravo-Ferrada et al., 2016).
Los óptimos resultados del crecimiento a pH ácido (3,5, 3,6, 3,7 y 3,8) se pueden atribuir al hecho de que UNQOe19, además de poseer genes de estrés (Iglesias et al., 2018) que pueden expresarse en estas condiciones letales, tiene la capacidad de elevar el pH del medio donde se encuentra debido a su elevada capacidad para consumir el ácido málico de forma rápida los primeros 5 días de FML e incrementar así el pH, (Manera et al., 2019). Esta adaptación le permitió mantenerse viable durante ese tiempo. Esto resulta interesante ya que el pH óptimo reportado para el crecimiento de una cepa de O. oeni está entre 4,3 y 4,8, y un pH de 3 o inferior impide prácticamente todo el crecimiento. En lo que respecta a la supervivencia en etanol al 10% a las 48hs (pH=4,5) se condice con resultados obtenidos en estudios anteriores que afirman que la resistencia al etanol varía según la cepa y se ha demostrado que O. oeni es una cepa muy tolerante a diferentes concentraciones de etanol y bajo pH (G-Alegría et al., 2004). Por último, la figura 4-D mostró que UNQOe19 resultó ser sensible a la actividad bacteriolítica de la lisozima en todas las concentraciones evaluadas (100, 250 y 500ppm) en el medio a tiempo final.
Con el fin de preservar la cepa UNQOe19 mediante desecación para ser presentada en formato seco con fines comerciales se estudiaron métodos de preservación evaluando su resistencia a la liofilización. Las células bacterianas se exponen a procesos de congelación y secado causando daño a la membrana celular, la desnaturalización de proteínas y ADN, y por tanto disminución de la supervivencia celular (Panoff, Thammavongs, Guéguen & Boutibonnes, 1998; Wolfe & Bryant, 1999). La supervivencia celular bacteriana depende de muchos factores, incluyendo las condiciones de crecimiento (Palmfeldt & Hahn-Haßgerdal, 2000) y el medio de protección (Font de Valdez, de Giori, de Ruiz Holgado & Oliver, 1983ª, Zhao & Zhang, 2009). En este trabajo se utilizaron como crio-preservantes trehalosa y maltodextrina. La trehalosa es un criprotector natural que consiste en un disacárido de la glucosa presente en muchos organismos capaces de sobrevivir en condiciones de deshidratación completa (De Antoni, Pérez, Abraham & Añón, 1989). Sus propiedades como la alta viscosidad, alto contenido de sólidos, adecuada solubilidad en agua la convierten en una buena matriz para estabilizar muestras biológicas durante la congelación y el secado (Santivarangkna, Higl & Foerst, 2008). La maltodextrina es un derivado de polisacáridos como el almidón y glucógeno. Su empleo representa diversas ventajas como bajo costo y amplia disponibilidad para su uso. La maltodextrina se caracteriza por su efectividad como crioprotector en la preparación de productos estables que contengan bacterias ácido lácticas probióticas (Reddy, Madhu & Prapulla, 2009). En este trabajo la trehalosa fue más eficaz para preservar la cepa UNQOe19 sin tratamiento previo (figura 5-A). Sin embargo, la figura 5-B mostró que no hubo diferencias significativas de viabilidad de UNQOe19 en trehalosa y maltodextrina ya que en este caso la cepa fue tratada previamente con medio de aclimatación para tolerar las condiciones estresantes mejorando así las condiciones de crecimiento.
La cepa UNQOe19 posee potencial para ser utilizada como cultivo iniciador de la FML tanto por sus propiedades tecnológicas, para sobrevivir a las condiciones estresantes propias de la vinificación y al proceso de liofilización, como a su capacidad de metabolizar sustratos alternativos como BM y PS suplementados. Los costos excesivos de los medios comerciales usados para sostener el crecimiento de BAL con rigurosos requerimientos nutricionales pueden ser reemplazados de forma económica y sustentable por las formulaciones diseñadas en el presente trabajo. Mediante un concepto de economía circular se ofrece una respuesta sustentable a la problemática de disposición de residuos alimentarios mediante la degradación microbiológica con fines de obtención de biomasa utilizable como insumo de la industria vitivinícola. Cabe destacar que el cultivo de O. oeni de interés enológico en permeado de suero no ha sido reportado al momento. Este potencial iniciador maloláctico autóctono resulta un recurso biológico para controlar la FML sin alterar el terroir aportando valor agregado a la vitivinicultura regional.
Alexandre, H., Costello, P.J., Remize, F., Guzzo, J. & Guilloux‐Benatier, M. (2004). Saccharomyces cerevisiae Oenococcus oeni interactions in wine: current knowledge and perspectives. International Journal of Food Microbiology 93(2): p. 141‐154.
Bauer, R. & Dicks, L.M.T. (2004). Control of malolactic fermentation in wine. South African Journal of Enology & Viticulture 25, 74-88.
Bourdineaud, J.P., Nehmé, B., Tesse, S. & Lonvaud-Funel, A. (2003). The fisH gene of the wine bacterium Oenococcus oeni is envolved in protection against environmental stress. Appl Environ Microbiol 69, 2511-2520.
Bravo-Ferrada, B. M., Tymczyszyn, E. E., Gómez-Zavaglia, A. & Semorile, L. (2014). Effect of acclimation medium on cell viability, membrane integrity and ability to consume malic acid in synthetic wine by oenological Lactobacillus plantarum strains. J Appl Microbiol 116, 360-367.
Bravo, S.M.E., Morales, M., Constenla, D. & Caballero, A.C. (2016). Caracterización y uso de bagazo de manzana para la producción de biomasa de levaduras autóctonas destinadas a vinificación. Congreso Internacional de Ciencia y Tecnología de los Alimentos CICyTAC 2016 - 2 al 4 de noviembre, Córdoba, Argentina.
Bravo-Ferrada, B.M., Hollmann, A., Brizuela, N., Valdés La Hens, D., Tymczyszyn, E.E. & Semorile, L. (2016). Growth and consumption of L-malic acid in wine-like medium by acclimated and non-acclimated cultures of Patagonian Oenococcus oeni strains. Folia Microbiol.
Bravo, S.M.E., Morales, M., del Mónaco, S.M., Caballero, A.C. (2019). Apple bagasse as a substrate for the propagation of Patagonian wine yeast biomass. J. Appl. Microbiol 126, 1414–1425.
Britz, T. J. & Tracey, R. P. (1990). The combination effect of pH, SO2, ethanol and temperature on the growth of Leuconostoc oenos. Journal of Applied Bacteriology 68, pp. 23‐31.
Brizuela, N. S. (2019). Cepas patagónicas de Lactobacillus plantarum y Oenococcus oeni como cultivos iniciadores de la fermentación maloláctica: estudio de las propiedades enológicas y tecnológicas. Tesis doctoral. Universidad Nacional de Quilmes. Recuperado de: https://ridaa.unq.edu.ar/handle/20.500.11807/2023
Brizuela, N. S., Franco‐Luesma, E., Bravo‐Ferrada, B. M., Pérez‐Jiménez, M., Semorile, L., Tymczyszyn, E. E., & Pozo‐Bayon, M. A. (2021). Influence of Patagonian Lactiplantibacillus plantarum and Oenococcus oeni strains on sensory perception of Pinot Noir wine after malolactic fermentation. Australian Journal of Grape and Wine Research 27(1), 118-127.
Carvalho, A.S., Silva, J., Ho, P., Teixeira, P., Malcata, F.X., Gibbs, P. (2023). Protective effect of sorbitol and monosodium glutamate during storage of freeze-dried lactic acid bacteria. Dairy Sci. Technol. 83, 203–210.
Cerdeira, V., Bravo-Ferrada, B.M., Semorile, L., Tymczyszyn, E. (2019). Design of a low-cost culture medium based in whey permeate for biomass production of enological Lactobacillus plantarum strains. Biotechnol Prog 35, e2791.
Cerdeira, V., Brizuela, N.S., Bravo, S.M., Bravo-Ferrada, B.M., Valdés La Hens, D., Caballero, A.C., Semorile, L. & Tymczyszyn, E.E. (2021). Use of Apple Pomace as Substrate for Production of Lactiplantibacillus plantarum Malolactic Starter Cultures. Fermentation 7, 244.
Costello, M. D., Morrison, G. J., Lee, T. H. & Flee, G. H. (1983). Numbers and species of lactic acid bacteria in wines during vinification. Food Tech Assoc Aus 35, 14-18.
Corral-Lugo, A. (et al.) (2012). Cuantificación de bacterias cultivables mediante el método de "Goteo en Placa por Sellado (o estampado) Masivo" Annals of microbiology 14(2), pp. 147-156.
Cui, S., Hang, F., Liu, X., Xu, Z., Liu, Z., Zhao, J., Zhang, H. & Chen, W. (2018) Effect of acids produced from carbohydrate metabolism in cryoprotectants on the viability of freeze-dried Lactobacillus and prediction of optimal initial cell concentration. J. Biosci. Bioeng. 125, 513–518.
De Antoni, G.L., Pérez., P., Abraham, A. & Añón, M. (1989). Trehalose, a cryoprotectant for Lactobacillus bulgaricus. Cryobiology 26, 149–153.
Fidelis, M., de Moura, C., Kabbas Junior, T., Pap, N., Mattila, P., Mäkinen, S., ... & Granato, D. (2019). Fruit seeds as sources of bioactive compounds: Sustainable production of high value-added ingredients from by-products within circular economy. Molecules 24(21), 3854.
Fiocco, D., Capozzi, V., Goffin, P., Hols, P. & Spano, G. (2007). Improved adaptation to heat, cold, and solvent tolerance in Lactobacillus plantarum. Appl Microbiol Biotechnol 77, 909-915.
Flores, N.E., Navarro, M., Tymczyszyn, E.E., Bravo-Ferrada, B.M., Semorile, L.C. y Valdés La Hens, D. (2022). Empleo de bagazo de manzana para la formulación de medios sustentables para optimizar el crecimiento de bacterias lácticas enológicas patagónicas. VIII Congreso Internacional de Ciencia y Tecnología de los Alimentos (CICyTAL), Córdoba, Argentina, 4 al 6-10-2022.
Font de Valdez, G., de Giori, G. S., de Ruiz Holgado, A. P. & Oliver, G. (1983a). Comparative study of the efficiency of some additives in protecting lactic acid bacteria against freeze-drying. Cryobiology 20, 560–566.
G-Alegría, E., López, I., Ignacio Ruiz, J., Sáenz, J., Fernández, E., Zarazaga, M., Dizy, M., Torres, C. & Ruiz-Larrea, F. (2004). High tolerance of wild Lactobacillus plantarum and Oenococcus oeni strains to lyophilization and stress environmental conditions of acid pH and ethanol. FEMS Microbiol Lett 230, 53-61.
Golowczyc, M., Vera, C., Santos, M., Guerrero, C., Carasi, P., Illanes, A., Gómez-Zavaglia, A. & Tymczyszyn, E. (2013). Use of whey permeate containing in situ synthesized galacto-oligosaccharides for the growth and preservation of Lactobacillus plantarum. Journal of Dairy Research 80(03), 374-381.
Gullón, B., Garrote, G., Alonso, J. L., & Parajo, J. C. (2007). Production of L-lactic acid and oligomeric compounds from apple pomace by simultaneous saccharification and fermentation: a response surface methodology assessment. Journal of Agricultural and Food Chemistry 55(14), 5580-5587.
Guzzo, J., Jobin, M. P., Delmas, F., Fortier, L. C., Garmyn, D., Tourdot-Maréchal, R., ... & Diviès, C. (2000). Regulation of stress response in Oenococcus oeni as a function of environmental changes and growth phase. International journal of food microbiology 55(1-3), 27-31.
Hayman D. C. & Monk P. R. (1982). Starter culture preparation for the induction of malolactic fermentation in wine. Food Tech Assoc Aus 34, 14-18.
Henick-Kling, T. (1993). Malolactic fermentation. G. H. Fleet (ed.). Wine microbiology and biotechnology. London: Taylor & Francis.
Henick-Kling, T. (1995). Control of malo-lactic fermentation in wine: energetics, flavour modification and methods of starter culture preparation. Journal of applied bacteriology 79.
Hugo, A. A., Bruno, F., & Golowczyc, M. A. (2016). Whey permeate containing galacto-oligosaccharides as a medium for biomass production and spray drying of Lactobacillus plantarum CIDCA 83114. LWT-food Science and Technology 69, 185-190.
Iglesias, N. G., Valdés La Hens, D., Olguín, N. T., Bravo-Ferrada, B. M., Brizuela, N. S., Tymczyszyn, E. E., Bibiloni, H., Caballero, A.C., & Semorile, L. (2018). Genome sequence of Oenococcus oeni UNQOe19, the first fully assembled genome sequence of a Patagonian psychrotrophic oenological strain. Microbiology resource announcements 7(5), e00889-18.
Krieger-Weber, S. (2017). Application of yeast and bacteria as starter cultures. Biology of Microorganisms on Grapes, in Must and in Wine, 605-634.
Kunkee, R.E. (1974). Malo-Lactic Fermentation and Winemaking. Advances in Chemistry; 137, Chapt 7, 151-170.
Lerm, E., Engelbrecht, L. & du Toit, M. (2010). Malolactic fermentation: the ABC´s of MLF. South African Journal of Enology & Viticulture 31,186-192.
Lu, Y. & Foo, L. Y. (1997). Identification and quantification of major polyphenols in apple pomace. Food Chemistry 59(2) 187-194.
Lu, Y. & Foo, L. Y. (2000). Antioxidant and radical scavenging activities of polyphenols from apple pomace. Food chemistry 68(1), 81-85.
Maicas, S., González-Cabo, P., Ferrer, S., & Pardo, I. (1999). Production of Oenococcus oeni biomass to induce malolactic fermentation in wine by control of pH and substrate addition. Biotechnology Letters 21(4), 349-353.
Manera, C., Olguin, N. T., Bravo-Ferrada, B. M., Tymczyszyn, E. E., Delfederico, L., Bibiloni, H., ... y La Hens, D. V. (2019). Survival and implantation of indigenous psychrotrophic Oenococcus oeni strains during malolactic fermentation in a Patagonian Pinot noir wine. LWT 108, 353-360.
Mesas, J. M., Rodriguez, M. C. & Alegre, M. T. (2004). Tolerancia de Oenococcus oeni RS1 a las condiciones de estres del vino. Cienc. Tecnol. Aliment 4(4),pp. 278-282.
Nault, I., Gerbaux, V., Larpent, J. P., & Vayssier, Y. (1995). Influence of pre-culture conditions on the ability of Leuconostoc oenos to conduct malolactic fermentation in wine. American journal of enology and viticulture 46(3), 357-362.
Palmfeldt, J. & Hahn-Ha¨gerdal, B. (2000). Influence of culture pH on survival of Lactobacillus reuteri subjected to freeze-drying. Int J Food Microbiol 55, 235–238.
Panoff, J. M., Thammavongs. B, Gue´guen, M. & Boutibonnes, P. (1998). Cold stress responses in mesophilic bacteria. Cryobiology 36, 75–83
Pilone, G. J., & Kunkee, R. E. (1972). Characterization and energetics of Leuconostoc oenos ML 34. American Journal of Enology and Viticulture 23(2), 61-70.
Quirós, C., Herrero, M., García, L. A. & Díaz, M. (2012). Effects of SO2 on lactic acid bacteria
physiology when used as a preservative compound in malolactic fermentation. J. Inst. Brew. 118, 89–96
Reddy, K.B.P., Madhu, S.P.A. & Prapulla, S. (2009). Role of cryoprotectants on the viability and functional properties of probiótico lactic acid bacteria during freeze drying. Food Biotechnol 23, 243-265.
Saeed, A.H. & Salam, A.I. (2013). Current limitations and challenges with lactic acid bacteria: A review. Food Nutr. Sci. 40133.
Santivarangkna, C., Higl, B. & Foerst, P. (2008). Protection mechanisms of sugars during different stages of preparation process of dried lactic acid starter cultures. Food Microbiol. 25, 429–441.
Schieber, A., Hilt, P., Streker, P., Endreß, H. U., Rentschler, C., & Carle, R. (2003). A new process for the combined recovery of pectin and phenolic compounds from apple pomace. Innovative Food Science & Emerging Technologies 4(1), 99-107.
Shalini, R., Gupta, D. K., & Singh, A. (2009). Drying kinetics of apple pomace cake. Journal of Food Science and Technology 46(5), 477.
Spano, G. & Massa, S. (2006). Environmental stress response in wine lactic acid bacteria: beyond Bacillus subtilis. Critical reviews in microbiology 32(2), 77-86.
Vendruscolo, F., Albuquerque, P. M., Streit, F., Esposito, E., & Ninow, J. L. (2008). Apple pomace: a versatile substrate for biotechnological applications. Critical reviews in biotechnology 28(1), 1-12.
Wang, G.Q., Pu, J., Yu, X.Q., Xia, Y.J. & Ai, L.Z. (2020). Influence of freezing temperature before freeze-drying on the viability of various Lactobacillus plantarum strains. J. Dairy Sci. 103, 3066–3075.
Wolfe, J. & Bryant, G. (1999). Freezing, drying, and/or vitrification of membrane-solute-water system. Cryobiology 39:103–129.
Zhao, G. & Zhang, G. (2009) Influences of protectants, rehydration media and storage on the viability of freeze-dried Oenococcus oeni for malolactic fermentation. World J. Microbiol. Biotechnol. 25, 1801–1806.

