Usos actuales y potencialidades de la membrana amniótica humana en medicina: Estado del arte en Argentina y perspectivas en investigación
Current medical applications and potential of human amniotic membrane: state of the art in Argentina and future research directions
Alejandro Berra Flavia Mariana Michelini Griselda N. Moreno María Ximena Guerbi Mariano Berra Matías Fabián Rotela Rocío Antonella ComitoMembrana amniótica humana
La membrana amniótica humana (hAM), o amnios, constituye la capa más interna de las membranas fetales unida de manera laxa al corion. Ambas membranas conforman el saco amniótico, que envuelve al embrión y contiene al líquido amniótico durante la gestación. La conexión entre estas membranas es flexible gracias a una capa de colágeno con estructura esponjosa (Arrizabalaga, & Nollert, 2018).
La hAM es un biomaterial translúcido y avascular, con un espesor que oscila entre 20 y 50 μm., constituido por una monocapa de células epiteliales cuboides y una membrana basal compuesta por diversos componentes de la matriz extracelular, como varios tipos de colágeno, elastina, laminina, fibronectina y ácido hialurónico. Además, contiene factores biológicamente activos, incluidos inhibidores de metaloproteinasas, citoquinas y factores de crecimiento.
Sus propiedades antiinflamatorias, antifibróticas, antimicrobianas, e inmunomoduladoras convierten a hAM en un biomaterial ideal para la regeneración tisular (Dua et al., 2004; Mamede et al., 2012). Se utiliza e investiga en el contexto del tratamiento para diversas patologías, ya que se ha reportado que proporciona una barrera biológica natural, mejora el proceso de cicatrización, provee una matriz para la migración celular, no es inmunogénica, reduce la inflamación, tiene propiedades anti bacterianas y reduce el dolor en el lugar de aplicación
Actualmente, en la mayoría de los casos, las placentas se descartan como material patogénico, implicando gastos por el descarte como residuo.
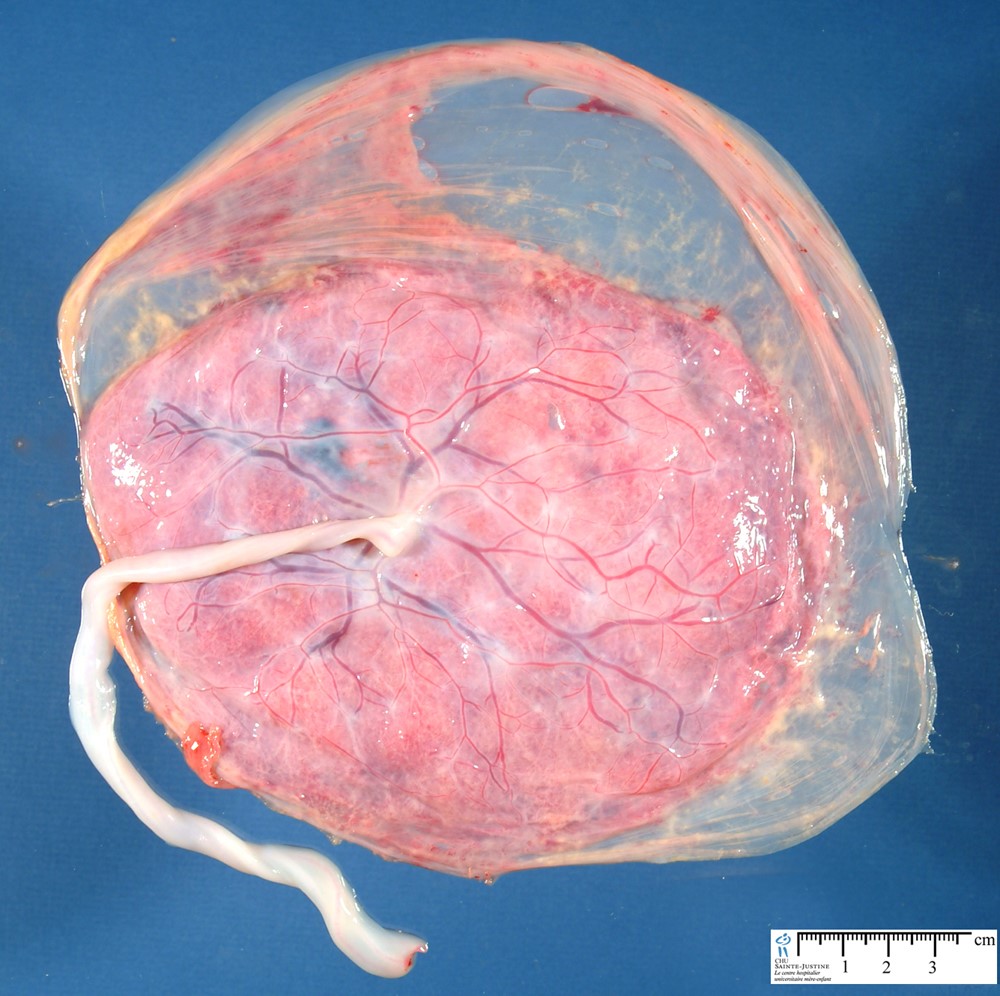
La hAM actúa mediante mecanismos de reepitelización, propiedades antiinflamatorias, actividades antiproliferativas y proapoptóticas, y propiedades inmunomoduladoras, lo que la hace útil en diversos tratamientos como pueden ser la curación de heridas, tratamiento del cáncer y regeneración de tejidos. Ha sido objeto de extensas investigaciones debido a sus propiedades únicas que la convierten en una herramienta valiosa en diversas aplicaciones médicas. A continuación, se detallan los principales mecanismos de acción identificados en su uso clínico:
Propiedades inmunomoduladoras
Las células epiteliales y mesenquimales derivadas de la hAM exhiben características de células madre, con capacidad de diferenciación hacia diversas líneas celulares y propiedades inmunomoduladoras. Estas células tienen HLA-G con una extremadamente baja expresión de antígenos del complejo mayor de histocompatibilidad, que reduce la posibilidad de rechazo inmunológico. Además, modula la respuesta de las células T y el ambiente inflamatorio local mediante la secreción de factores como interleucina-10 (IL-10), factor de crecimiento transformante beta 1 (TGF-β1), factor de crecimiento de hepatocitos (HGF), indolamina 2,3-dioxigenasa (IDO) y prostaglandina E2 (PGE2). Estos mecanismos contribuyen a la regulación del sistema inmunológico y a la reducción de respuestas inflamatorias excesivas, es decir, las células de la membrana amniótica tienen propiedades inmunorreguladoras, inhibiendo la proliferación de linfocitos y la producción de citoquinas proinflamatorias (Rossi et al 2012, Insausti et al. 2024).
Estimulación de la cicatrización
La hAM aplicada sobre una herida al exterior, actúa como una cubierta biológica que mantiene la humedad de la herida, reduce el dolor al cubrir las terminaciones nerviosas expuestas y promueve la epitelización debido a la presencia de factores de crecimiento como el factor de crecimiento epidérmico (EGF), factor de crecimiento transformante alfa (TGF-α), factor de crecimiento de queratinocitos (KGF), factor de crecimiento de hepatocitos (HGF) y factor de crecimiento de fibroblastos básico (bFGF). Además, favorece la formación de tejido de granulación al estimular la angiogénesis y posee efectos antiinflamatorios por su contenido en IL-10 e inhibidores de metaloproteinasas, lo que contribuye a la remodelación controlada y satisfactoria. También controla la proliferación bacteriana gracias a su contenido en lisozimas e inmunoglobulinas E (Piñera et al. 2020).
La hAM reduce la interacción entre monocitos y endotelio, y disminuye la expresión de moléculas de adhesión vascular e intracelular en células endoteliales. Además, mejora la formación de vasos y la migración celular, lo que es beneficioso en la cicatrización de heridas (Pipino et al 2022).
Aplicaciones en ingeniería tisular y medicina regenerativa
La hAM y sus células madre epiteliales y mesenquimales se consideran una fuente adecuada para la ingeniería de tejidos y la medicina regenerativa. Su capacidad para diferenciarse en las tres capas germinales y su potencial terapéutico las posicionan como candidatas prometedoras en la regeneración de tejidos dañados (García de Insausti, 2012). La hAM promueve la regeneración de tejidos debido a su matriz extracelular rica en colágeno y células activas biológicamente, lo que la hace útil en la regeneración de la piel y otras aplicaciones quirúrgicas (Muñoz et al 2023).
Como soporte estructural y andamiaje celular
La matriz de hAM exhibe características ideales para la ingeniería de tejidos, debido a la presencia de proteínas extracelulares como colágenos, lamininas y fibronectinas. Estas proteínas sirven como ancla para la fijación y proliferación celular, proporcionando un lecho adecuado para la administración de células y/o actuando como reservorio de fármacos y factores de crecimiento involucrados en el proceso de cicatrización de heridas (Lacorzana, 2020).
Propiedades Anticancerígenas
La hAM puede secretar factores como trombospondina, inhibidores de metaloproteinasas, y citoquinas que contribuyen a su actividad anticancerígena. Sin embargo, los mecanismos exactos de estas propiedades aún no están completamente claros (Hossain et al., 2019).
Diversos estudios han demostrado que la hAM posee propiedades anticancerígenas al inhibir la angiogénesis tumoral mediante varios de sus componentes bioactivos. Entre ellos, se destaca el colágeno tipo VIII, secretado por las células epiteliales y mesenquimales, que al hidrolizarse tras su aplicación genera endostatina, un potente inhibidor de la angiogénesis de amplio espectro. Además, la trombospondina-1, una proteína de matriz presente en hAM, ejerce efectos antiangiogénicos tanto directos como indirectos al limitar la movilidad de las células endoteliales, inducir su apoptosis y bloquear la interacción de factores proangiogénicos con sus receptores.
Por otro lado, los inhibidores de metaloproteinasas (TIMPs) presentes en hAM suprimen la actividad de las metaloproteinasas, impidiendo la degradación de la matriz extracelular y frenando así la angiogénesis y el crecimiento tumoral. Asimismo, los inhibidores del activador de plasminógeno (PAI-1 y PAI-2) evitan la degradación de la matriz extracelular, dificultando la invasión tumoral. La IL-10 contribuye a la inhibición angiogénica al bloquear MMP-2 y MMP-9 y promover la expresión de TIMP-1. Finalmente, el antagonista del receptor de interleucina-1 (IL1RN) disminuye la expresión de factores angiogénicos como VEGF e IL-8, y de este modo colabora a contrarrestar la progresión maligna del tumor.
La hAM se utiliza actualmente en medicina humana para la regeneración de tejidos en oftalmología, dermatología, ortopedia, cirugía plástica, traumatología y gerontología entre otras.
Oftalmología
La hAM es empleada en el tratamiento de diversas patologías oculares, especialmente aquellas que afectan la córnea y conjuntiva. Su uso en oftalmología está respaldado por su capacidad para reducir la inflamación, modular la cicatrización y promover la reepitelización (Tseng et al. 2004; Lee & Tseng, 1997).
Se ha demostrado que la hAM favorece la regeneración epitelial y disminuye el riesgo de opacificación corneal en úlceras de difícil cicatrización (Srinivasan et al., 2021). En el síndrome de Stevens-Johnson y quemaduras químicas, su aplicación como injerto promueve la recuperación epitelial y reduce la inflamación en pacientes con daño severo de la superficie ocular (Dua et al., 2004). En la enfermedad de Pterigión recurrente, disminuye la inflamación postquirúrgica y reduce la tasa de recurrencia tras la escisión del pterigión (Lee & Tseng, 1997). En defectos epiteliales persistentes se ha demostrado que actúa como un sustrato biológico temporal que facilita la migración celular y la restauración del epitelio corneal (Niknejad et al., 2008).
Dermatología y cirugía plástica
La hAM ha demostrado ser un eficaz sustituto dérmico en diversas condiciones cutáneas. Sus propiedades antimicrobianas y su capacidad para modular la inflamación la han convertido en una opción en el tratamiento de heridas crónicas complejas (Fernández-Pérez et al., 2021; Mamede et al., 2012). En úlceras crónicas (diabéticas, venosas, por presión) mejora la cicatrización y reduce el riesgo de infecciones en úlceras de difícil tratamiento (Koob et al., 2015). En quemaduras de segundo y tercer grado actúa como una cobertura biológica que favorece la regeneración dérmica y minimiza la formación de cicatrices hipertróficas (Murphy et al., 2010). En heridas quirúrgicas complejas, su uso ha sido reportado en cirugías reconstructivas, donde contribuye a la cicatrización sin excesiva fibrosis (Fernández-Pérez et al., 2021).
Ortopedia y traumatología
El uso de la hAM en ortopedia y traumatología ha crecido en los últimos años, especialmente en el tratamiento de enfermedades musculoesqueléticas degenerativas y lesiones tendinosas (Srinivasan et al., 2021). En osteoartritis se ha utilizado en inyecciones intraarticulares para reducir la inflamación y mejorar la función articular (Niknejad et al., 2008). En reparación de tendones y cartílago favorece la regeneración tisular y reduce la formación de adherencias postquirúrgicas en lesiones tendinosas y cartilaginosas (Koob et al., 2015). En el caso de fracturas y defectos óseos su combinación con biomateriales ha mostrado resultados prometedores en la osteointegración y reparación de defectos óseos (Murphy et al., 2010).
Cirugía general y ginecología
En cirugía general y ginecológica, la hAM ha sido utilizada como barrera biológica para prevenir adherencias postquirúrgicas y mejorar la cicatrización en diversas intervenciones (Dua et al. 2004). Se utiliza en reparación de fístulas y defectos peritoneales, donde su aplicación ha mostrado eficacia en la reducción de adherencias y en la reparación de defectos tisulares en cirugía abdominal (Niknejad et al., 2008). En recubrimiento de cirugías ginecológicas, se ha utilizado para el tratamiento de la endometriosis y en reconstrucciones vaginales, donde favoreció la regeneración epitelial (Srinivasan et al., 2021).
Odontología y cirugía maxilofacial
La hAM se ha integrado en la odontología regenerativa debido a su capacidad para promover la regeneración ósea y de tejidos periodontales (Fernández-Pérez et al., 2021). Se utiliza como biomaterial en procedimientos de aumento óseo y regeneración periimplantaria (Koob et al., 2015), en tratamientos de defectos periodontales y en defectos óseos alveolares (Murphy et al., 2010).
Medicina regenerativa e ingeniería de tejidos
El uso de la hAM en ingeniería de tejidos ha abierto nuevas posibilidades en terapias avanzadas y biomedicina (Niknejad et al., 2008; Murphy et al., 2010). Resulta útil para la construcción de andamios celulares en terapias avanzadas. Su estructura tridimensional permite su uso como sustrato para el cultivo celular y la bioingeniería de tejidos (Srinivasan et al., 2021). En tratamientos con células madre ha demostrado ser un microambiente adecuado para la proliferación y diferenciación celular en terapias basadas en células madre (Koob et al., 2015).
Según lo antedicho, las aplicaciones clínicas de la hAM han crecido significativamente en los últimos años, abarcando múltiples disciplinas médicas. Su capacidad para modular la inflamación, promover la regeneración tisular y reducir la fibrosis la posiciona como un biomaterial clave en la medicina regenerativa. A medida que avanzan las investigaciones en bioingeniería y biotecnología, es probable que surjan nuevas aplicaciones y formulaciones optimizadas para su uso clínico.
Injerto en lámina o parche
La hAM en forma de lámina o parche es una de las presentaciones más utilizadas, particularmente en oftalmología, dermatología, cirugía plástica y medicina regenerativa. Este tipo de injerto puede aplicarse directamente sobre tejidos lesionados para proporcionar una matriz extracelular que favorezca la reparación epitelial y minimice la fibrosis (Dua et al., 2004).
Polvo o matriz deshidratada
El procesamiento de la hAM en forma de polvo o matriz deshidratada permite su uso en aplicaciones ortopédicas, odontológicas y quirúrgicas. Esta forma conserva los factores de crecimiento presentes en la matriz amniótica, lo que favorece la regeneración de tejidos óseos y dérmicos en heridas de difícil cicatrización (Mamede et al., 2012).
Hidrogel o suspensión
La hAM procesada en forma de gel o suspensión es utilizada en medicina regenerativa y cirugía ortopédica para el tratamiento de lesiones articulares y tendinosas. Este formato permite una mayor integración en el sitio de lesión y puede combinarse con terapias celulares para mejorar la regeneración tisular (Niknejad et al., 2008).
Membranas especializadas para oftalmología
Existen presentaciones de hAM diseñadas específicamente para aplicaciones oftalmológicas, como aquellas utilizadas en cirugías de reconstrucción de la superficie ocular. Estas membranas pueden aplicarse mediante suturas o adhesivos biológicos para estabilizar defectos corneales y facilitar la epitelización en patologías como el síndrome de Stevens-Johnson y el pterigión recurrente (Lee & Tseng, 1997).
Membrana amniótica en esponja o soporte tridimensional
El desarrollo de soportes tridimensionales a partir de la hAM ha permitido su aplicación en ingeniería de tejidos. Estas estructuras proporcionan un andamiaje adecuado para el crecimiento celular y la diferenciación en terapias avanzadas, incluyendo la regeneración de tejidos epiteliales y cartilaginosos (Murphy et al., 2010). Estudios recientes han demostrado su potencial en modelos de bioimpresión y terapia celular (Koob et al., 2015).
En Argentina, el uso de la hAM ha crecido en los últimos años, con aplicaciones en oftalmología, dermatología y cirugía plástica. Sin embargo, su disponibilidad y regulación aún representan desafíos.
Instituciones de investigación, ONGs y hospitales han comenzado a desarrollar protocolos estandarizados para su procesamiento y aplicación en nuevas terapias regenerativas.
Los bancos de tejidos de amnios pueden proveer a profesionales e instituciones habilitadas las formas criopreservada y/o liofilizada y esterilizada. Actualmente el uso es quirúrgico y no quirúrgico. La desventaja de la hAM criopreservada es que debe ser transportada y almacenada a -80°C hasta el momento de su aplicación. Por el contrario, la hAM liofilizada y esterilizada se transporta y almacena a temperatura ambiente con un vencimiento superior a los 3 años.
Obtención y Donación de Placentas
En Argentina, la obtención de hAM se realiza a partir de placentas donadas por mujeres que han tenido partos por cesárea programada y en algunos casos parto natural. Las donantes deben cumplir criterios específicos, como ser mayores de edad, tener embarazos controlados y resultados negativos en pruebas serológicas para infecciones para Sífilis, HTLV 1 y 2; Brucelosis, Chagas, CMV, VIH y hepatitis B. La donación se formaliza mediante un consentimiento informado para el uso del tejido con fines médicos y/o de investigación.
Para que los hospitales tengan la posibilidad de recibir las donaciones de placentas, deben contar con un convenio con alguno de los bancos de hAM previamente mencionados. Debe garantizarse la logística de recolección, conservación y transporte tras el alumbramiento, hasta su llegada al banco para el procesamiento.
Para que los hospitales puedan procurar placentas para su donación, dichas instituciones deben contar con un servicio de obstetricia con quirófano. Los bancos de membrana amniótica les proveen de un kit contenedor, los instructivos y la capacitación para la recolección y el almacenamiento.
El procesamiento de la hAM implica su recolección en condiciones estériles, seguida de una serie de procedimientos que incluyen la limpieza, con o sin desepitelización y conservación. En caso de que la hAM sea provista en su forma criopreservada se trata con soluciones antibióticas y se almacena a temperaturas de -80°C para mantener sus propiedades biológicas. En caso de que sea liofilizada y esterilizada, se procesa sin antibióticos, se liofiliza y se esteriliza por radiación gamma. En todos los casos el procesamiento se realiza en un área limpia clase C, en cabina de seguridad biológica clase A.
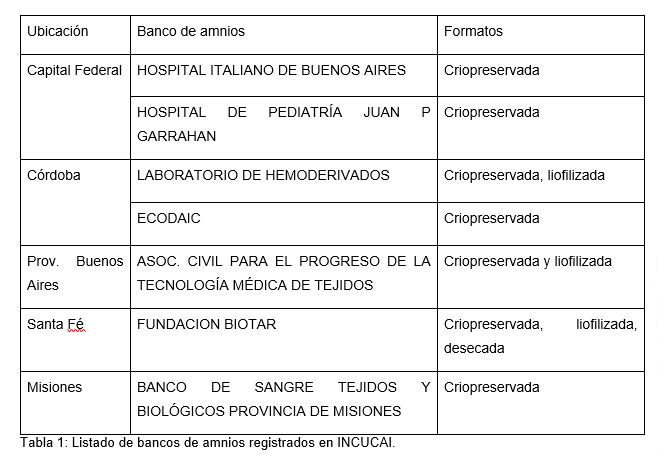
En Argentina existen siete bancos de membrana amniótica habilitados por INCUCAI (Ver tabla 1).
En la resolución 187/2001 del Ministerio de Salud de Argentina se establecen las normas y procedimientos para la creación y funcionamiento de un banco de membrana amniótica en Argentina. Algunos puntos clave incluyen:
*Regulación del banco de membrana amniótica: Se define la membrana amniótica como un tejido biológico con aplicaciones terapéuticas en oftalmología, dermatología y otras especialidades. Se establecen los criterios de selección de donantes, incluyendo requisitos de salud y pruebas serológicas para prevenir la transmisión de enfermedades.
*Requisitos para la obtención y procesamiento: La membrana debe obtenerse de cesáreas programadas, con el consentimiento informado de la donante. Se deben seguir protocolos de recolección, procesamiento y conservación bajo normas de bioseguridad.
*Control de calidad y almacenamiento: Se detallan las pruebas microbiológicas y fisicoquímicas para garantizar la calidad y seguridad del tejido. Se especifican los métodos de almacenamiento, incluyendo la criopreservación.
*Normas éticas y legales: Se establece la necesidad de un consentimiento informado por parte de la madre donante. El banco de membrana amniótica debe operar bajo la supervisión de las autoridades sanitarias competentes.
Por su parte, la resolución 332/2024 emitida en octubre de 2024 por el Instituto Nacional Central Único Coordinador de Ablación e Implante (INCUCAI), actualiza las normativas relacionadas con la habilitación de establecimientos y la autorización de profesionales para la ablación e implante de diversos tejidos. Implementa registros específicos para establecimientos y profesionales habilitados para el trasplante de Membrana Amniótica.
*Responsabilidad en el Registro de Receptores: Se establece que tanto el director médico del establecimiento como los profesionales autorizados son responsables de mantener actualizado el Registro de Receptores de Tejidos en el Sistema Nacional de Información de Procuración y Trasplante de la República Argentina (SINTRA).
Centros de Donación y Procesamiento
Diversos hospitales y clínicas en Argentina participan en la donación y procesamiento de placentas:
Hospital Garrahan (Buenos Aires): surge en 2002, es el primer banco de membrana amniótica de Argentina. Procesa y conserva hAM para su distribución en todo el país. Durante 2002, en el banco del Garrahan fueron procesados 120 cortes de 16 cm2 de amnios, y 100 de ellos se los utilizó en intervenciones oftalmológicas. Para tratamientos en quemados, se almacenaron 4000 cm2 de amnios y se utilizaron 950 (Shapira, 2002).
Hasta el 2008, el Banco de Tejidos del Hospital Garrahan (BTHG) ha procesado 3333 fragmentos de hAM destinados al tratamiento de quemados y 1983 fragmentos destinados a oftalmología. De estos tejidos, se estima que 2850 fueron aplicados para tratamiento de quemaduras y 1236 fueron implantados para el tratamiento de enfermedades oftalmológicas. Del total de tejidos que procesa el banco, se estima que el 44% se destinó a su uso en instituciones provinciales, el 22% en instituciones municipales, el 25% en instituciones privadas y el 9% en otros tipos de establecimientos. Su infraestructura se encuentra dividida en varios sectores especializados, a saber: Sector de preprocesamiento que incluye una heladera común, almacenamiento de insumos y dos bateas para limpieza; sala de procesamiento que cuenta con un sector de lavado, tres gabinetes de flujo laminar (dos de seguridad biológica y uno vertical), esclusas para ingreso de material y personas, y una selladora de vacío; sector administrativo que se encarga de la comunicación, recepción de información, elaboración de estadísticas, organización de datos de tejidos, coordinación de envíos, recepciones, y elaboración de comunicados; sector de depósito, diseñado para almacenar una amplia variedad de insumos bajo condiciones específicas, asegurando la disponibilidad y calidad de los materiales necesarios para el procesamiento de tejidos en cualquier momento; sector de investigación que dedicado al análisis y desarrollo continuo de la actividad del banco, con proyectos de investigación en curso y almacenamiento de materiales útiles para futuros desarrollos; sector de almacenamiento criogénico y criopreservación, equipado con heladeras, freezers de -80°C, tanque de conservación criogénica de nitrógeno líquido, equipo de descenso programado de temperatura, shippers para transporte de tejidos en fase gaseosa de nitrógeno líquido. El BTHG también utiliza los laboratorios de microbiología, serología, esterilización y otros servicios de apoyo del hospital para optimizar costos y cumplir con normativas nacionales e internacionales (Hospital de Pediatría S.A.M.I.C. Prof. Dr. Juan P. Garrahan).

Banco Multitejidos Ecodaic (Córdoba): Se encuentra operativo para la obtención de membrana amniótica, desde el año 2012, y a través de convenios con instituciones tales como, la Clínica Universitaria Reina Fabiola, el Hospital Privado Universitario de Córdoba y el Hospital Misericordia.
Las donaciones, que se recibieron desde 2018, significaron un total de 350.000 cm2 de membrana. Estos tejidos se utilizaron para realizar parches en el tratamiento de heridas oculares, úlceras y quemaduras en la piel. En octubre del 2023, el banco recibió su placenta número 500 y se estima que con este trabajo se mejoró la calidad de vida de 400 personas. En 2015 obtuvo la certificación de calidad ISO 9001:2015 por parte de IRAM, la cual se fue renovando anualmente. Esta norma se enfoca en tres pilares: gestión de riesgos, Sistema de Gestión de Calidad (SGC) y estructura funcional. Se asegura la calidad en todas las etapas: obtención, procesamiento, almacenamiento, liberación y trazabilidad de tejidos osteotendinosos y de membrana amniótica (Ministerio de Salud de la Provincia de Córdoba, 2024).
Amnios BMA (Provincia de Buenos Aires): es una institución dedicada a la producción, provisión y distribución de diferentes presentaciones de membrana amniótica humana. Además, desarrolla nuevos productos con aplicaciones tanto quirúrgicas como no quirúrgicas, y participa activamente en proyectos de investigación básica y traslacional.
El banco garantiza la calidad de sus productos mediante la implementación de un sistema de gestión de calidad que incluye procedimientos operativos estandarizados (POEs), manual de calidad, gestión de desvíos, y programas de calibración y calificación del equipamiento. El personal recibe capacitación anual, y se han validado múltiples procesos críticos como el transporte de placentas y de membranas amnióticas criopreservadas, la liofilización, y la esterilización por radiación gamma. Asimismo, se realizan ensayos de hermeticidad, estudios de estabilidad, y pruebas de citotoxicidad in vitro y toxicidad dérmica en modelo animal, siguiendo los lineamientos de la norma ISO 10993. El análisis de riesgos se encuentra alineado con la norma ISO 14971.
La trazabilidad de los productos está asegurada desde el origen: los hospitales que remiten las placentas deben contar con refrigeradores exclusivos para su almacenamiento y congeladores para los paquetes de frío. El transporte se realiza en conservadoras térmicas con triple bolsa y control de temperatura entre 2 y 8 °C, verificable mediante dataloggers individuales. Al llegar al banco, se controla la documentación, se asigna un número de lote, y se realiza el análisis de muestras sanguíneas de las donantes que acompaña a las placentas donadas. El procesamiento se lleva a cabo en un plazo máximo de 24 horas, dentro de una cabina de seguridad biológica clase 100 ubicada en un área clase 10.000 con presión positiva. La liofilización también se realiza en condiciones controladas dentro del área clase 10.000, y la esterilización final se lleva a cabo por radiación gamma en la planta de IONICS. Los controles serológicos y de carga biológica (bioburden) son obligatorios antes de la liberación del lote, la cual requiere la aprobación conjunta del Director Médico y Técnico.
La distribución de los productos se realiza exclusivamente a profesionales e instituciones habilitados por el INCUCAI, mediante el registro en formularios específicos de solicitud e implante. Cada unidad es trazada a través de un sistema de registro por lote que permite el seguimiento completo del material desde su origen hasta su aplicación clínica.
Actualmente, el banco ofrece tres presentaciones habilitadas de productos derivados de hAM, adaptadas a distintos usos clínicos: apósitos elaborados a partir de hAM homogeneizada, liofilizada y esterilizada; parches compuestos por hAM liofilizada y esterilizada; e insertos con las mismas características de procesamiento.

Los apósitos, parches o insertos de hAM se transportan y almacenan a temperatura ambiente (15 a 25°C). Pueden ser de uso no quirúrgico en el consultorio, así como utilizarse en quirófano.
Los apósitos y los parches de hAM pueden ser aplicados de forma tópica sobre el lecho de la herida, repitiendo el procedimiento cada 72 horas. Sus aplicaciones incluyen heridas, úlceras en pie diabético, úlceras varicosas, úlceras por presión, quemaduras AB, enfermedades poco frecuentes, epidermolisis bullosa, lesiones dérmicas traumáticas, enfermedades mucosinequiantes, defectos epiteliales, úlceras corneales persistentes, lesiones, químicas, pterigion.
Los insertos, al ser de un tamaño pequeño, presentan la ventaja de aplicarse bajo el saco conjuntival en patologías oftálmicas como defectos en córnea y superficie ocular, queratitis, úlceras neurotróficas, queratopatía bullosa dolorosa, SLET, neoplasias corneo-conjuntivales, enfermedades mucosinequiantes, defectos epiteliales, úlceras corneales persistentes, lesiones químicas, Pterigion, y patologías de retina como los agujeros maculares.
Desde el comienzo de procesamiento por parte del banco en 2020 a la actualidad, han recibido y procesado 1264 placentas. De los productos obtenidos, el 22% se utilizó en instituciones privadas, mientras que el 78% restante se aplicaron en instituciones públicas. Se estima que 1522 pacientes lograron acceder a un tratamiento con hAM provisto por AMNIOS BMA, en 16 provincias argentinas (Datos provistos por directivos del banco).
Laboratorio de Hemoderivados-Universidad Nacional de Córdoba (Córdoba): es una institución que elabora productos médicos, con carácter industrial y universitario. Fundado en 1964 con el objetivo de desarrollar y elaborar medicamentos derivados del plasma humano, en el año 2003 amplió su actividad incorporando la procuración, procesamiento y distribución de tejidos humanos para uso terapéutico en odontología y medicina. Actualmente, cuenta con una Planta Procesadora de Tejidos Biológicos habilitada por el INCUCAI y ANMAT, donde se procesan derivados de hueso humano y membrana amniótica.
Entre sus productos, se destaca la membrana de colágeno Amnios, una membrana amniótica parcialmente descelularizada, liofilizada e irradiada. Esta se presenta en diversos tamaños estándar (2 × 3 cm, 4 × 4 cm, 10 × 10 cm) o puede elaborarse a demanda según la especialidad y el tipo de procedimiento. Desde el punto de vista funcional, la membrana promueve la proliferación y migración celular, actúa como barrera biológica semipermeable, inhibe la fibrosis y la inflamación, y proporciona un efecto tectónico, al servir de soporte estructural en defectos tisulares. Su uso favorece la regeneración de tejidos y contribuye a la reducción del dolor postoperatorio. Se trata de un producto biocompatible, implantable y reabsorbible, caracterizado por su esterilidad, ausencia de toxicidad y pirógenos, así como por su buena elasticidad, flexibilidad y permeabilidad. Contiene fibras de colágeno tipo I y III, y puede conservarse por hasta cinco años a temperaturas entre 5 °C y 30 °C.
Membrana Amniótica (entera y a medida), criopreservada o fresca glicerolada en triple bolsa estéril sellada. Están Indicadas para uso odontológico (Ej: cirugías máxilo facial), oftalmológico (Ej: enfermedades mucosinequiantes, patología de superficie ocular, reconstrucción de fondos de saco, queratopatía bullosas fáquicas y pseudofáquicas), dermatológicos (quemaduras), cirugía reparadora y otras indicaciones médicas.

Banco de tejidos de Fundación Biotar (Santa Fé): Fundado en marzo de 2004, se dedica a la investigación, acopio, preservación de tejidos y biomateriales para su posterior utilización con fines terapéuticos o de investigación.
Cuenta con tres presentaciones: membrana amniocoriónica desecada, membrana amniótica desecada, membrana amniótica oftalmológica liofilizada.

En nuestro país, diversos grupos de investigación analizan los usos terapéuticos de la hAM, con enfoques que abarcan desde aplicaciones clínicas hasta desarrollos en ingeniería tisular y medicina regenerativa. A continuación, se detallan algunas de las principales líneas de investigación identificadas a través del buscador oficial del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET):
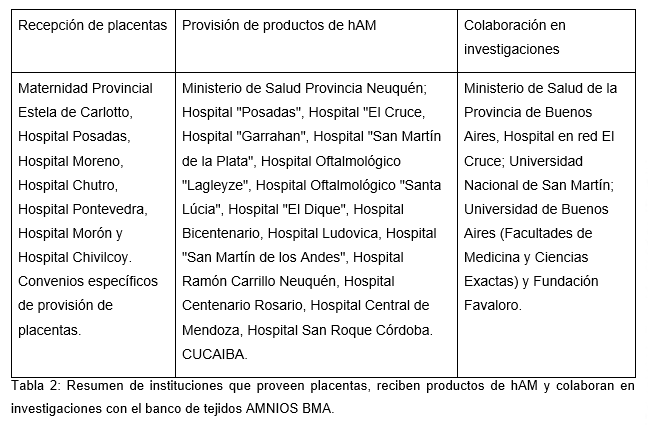
*Centro de Medicina Traslacional – Hospital en Red El Cruce: Este grupo investiga el uso de hAM en el tratamientos de heridas complejas detectadas en el pie diabético, las enfermedades virales (infección por virus sincicial respiratoio y herpes) y afecciones oftalmológicas que incluyen el ojo seco exacerbado por contaminación ambiental. La investigación se lleva a cabo en colaboración con el Banco de Tejidos AMNIOS BMA.
*Instituto Argentino de Veterinaria, Ambiente y Salud – Universidad Juan Agustín Maza: Este equipo trabaja en el desarrollo de terapias innovadoras para la degeneración macular asociada a la edad, en cooperación con AMNIOS BMA.
*Instituto de Estudios Inmunológicos y Fisiopatológicos – CCT La Plata, CONICET: Se enfoca en los mecanismos promovidos por componentes de la hAM y su aplicación en terapias innovadoras para la cicatrización de úlceras del pie diabético, también en articulación con AMNIOS BMA.
*Instituto de Química Biológica – Facultad de Ciencias Exactas y Naturales, CONICET: Investiga la diferenciación hepática de células madre epiteliales amnióticas, su caracterización y potencial clínico, incluyendo sus propiedades antitumorales. Esta línea de trabajo también se desarrolla en conjunto con el Banco de Tejidos AMNIOS BMA.
*Instituto de Investigaciones Biológicas y Tecnológicas – Córdoba, CONICET: Desarrolla plataformas bioartificiales mediante ingeniería tisular, con énfasis en matrices tridimensionales funcionales como andamios biológicos. Esta línea se desarrolla en colaboración con el Laboratorio de Hemoderivados de la Universidad Nacional de Córdoba.
*Instituto de Medicina Traslacional, Trasplante y Bioingeniería – CONICET: Investiga estrategias de terapia génica para inducir remodelado inverso en un modelo ovino de insuficiencia cardíaca crónica. Dentro de este marco, se evalúa el efecto angiogénico y proliferativo de la hAM descelularizada en cultivo de cardiomiocitos, en colaboración con AMNIOS BMA y la Fundación Favaloro.
Estos proyectos reflejan el creciente interés científico en el país por el aprovechamiento de la hAM como herramienta terapéutica innovadora, con potencial impacto en múltiples áreas de la salud humana.
La creciente evidencia científica en torno al uso de la hAM como biomaterial terapéutico destaca su versatilidad y eficacia en múltiples especialidades médicas. Sus propiedades inmunomoduladoras, antiinflamatorias, antifibróticas y regenerativas, combinadas con su baja inmunogenicidad y su capacidad de integrarse en diferentes formatos terapéuticos, posicionandola como una herramienta innovadora en el campo de la medicina regenerativa. La diversidad de mecanismos de acción descritos, como la liberación de factores de crecimiento, la regulación del microambiente inmunológico, la promoción de la angiogénesis o la inhibición de la proliferación celular en contextos tumorales, refleja un potencial terapéutico aún en expansión.
En el contexto argentino, el desarrollo de bancos de tejidos públicos y privados ha permitido avanzar en la producción, conservación y distribución de hAM en diferentes presentaciones (criopreservada, liofilizada, en polvo, en insertos o parches), adecuándose a las demandas clínicas y a las condiciones logísticas del sistema de salud. A pesar de los avances tecnológicos y de la estandarización de protocolos en instituciones como el Hospital Garrahan, Ecodaic, Amnios BMA o el Laboratorio de Hemoderivados de la UNC, persisten desafíos regulatorios, especialmente en lo que respecta a la promoción de la donación placentaria, la trazabilidad del material biológico y la articulación interinstitucional.
Asimismo, si bien el uso clínico se encuentra en expansión, el desarrollo de nuevas aplicaciones y dispositivos biomédicos basados en hAM requiere de una mayor inversión en investigación traslacional, ensayos clínicos multicéntricos y políticas públicas que fomenten la innovación terapéutica nacional. La integración entre bancos de tejidos, hospitales públicos y centros de investigación, como los articulados con CONICET, es clave para avanzar en estos objetivos.
En conclusión, la hAM representa un recurso biológico valioso, seguro y eficaz que, con el soporte adecuado, puede convertirse en una herramienta clave para mejorar la calidad de vida de miles de pacientes. Su implementación como tratamiento accesible en el ámbito de la salud pública requiere del fortalecimiento de marcos regulatorios, de la ampliación de la red de donación y de la continuidad en la generación de evidencia científica nacional.
Arrizabalaga, J., & Nollert, M. (2018). Human Amniotic Membrane: A Versatile Scaffold for Tissue Engineering. ACS biomaterials science & engineering, 4 7, 2226-2236. DOI: https://doi.org/10.1021/ACSBIOMATERIALS.8B00015
Baum, J. (2002). Amniotic Membrane Transplantation: Why is it Effective? Cornea, 21, 339-341. DOI:https://doi.org/10.1097/00003226-200205000-00001.
Cheung, C. (2004). Vascular Endothelial Growth Factor Activation of Intramembranous Absorption: A Critical Pathway for Amniotic Fluid Volume Regulation. Journal of the Society for Gynecologic Investigation, 11, 63 - 74. DOI:https://doi.org/10.1016/j.jsgi.2003.09.002.
Dua, H., Gomes, J., King, A., & Maharajan, V. (2004). The amniotic membrane in ophthalmology. Survey of ophthalmology, 49 1, 51-77. DOI:https://doi.org/10.1016/J.SURVOPHTHAL.2003.10.004.
Fitriani, N., Wilar, G., Narsa, A., Mohammed, A., & Wathoni, N. (2023). Application of Amniotic Membrane in Skin Regeneration. Pharmaceutics, 15. DOI:https://doi.org/10.3390/pharmaceutics15030748.
Fernández-Pérez, J., et al. (2021). Applications of amniotic membrane in dentistry: A review. Materials Science & Engineering: C, 118, 111374.
García de Insausti, C. L. (2012). Aislamiento y caracterización de las células madre de la membrana amniótica: una nueva fuente para terapia celular e inmuno-modulación [Tesis doctoral, Universidad de Murcia]. Digitum. http://hdl.handle.net/10201/27479
Hospital de Pediatría S.A.M.I.C. Prof. Dr. Juan P. Garrahan. (s. f.). Portal del Hospital Garrahan, sección Estadística – Servicio de Banco de Tejidos. Recueprado de:https://www.garrahan.gov.ar/estadistica-banco-tejidos
Hospital Pediatría S.A.M.I.C. Prof. Dr. Juan P. Garrahan. (2025). Portal del Hospital Garrahan, sección criopreservación. Recuperado de: https://www.garrahan.gov.ar/criopreservacion
Hossain, L., Siddika, A., Adnan, M., Diba, F., Hasan, Z., & Asaduzzaman, S. (2019). Human Amniotic Membrane and Its Anti-cancer Mechanism: a Good Hope for Cancer Therapy. SN Comprehensive Clinical Medicine, 1-9. DOI:https://doi.org/10.1007/s42399-019-00090-5.
Insausti, C., Blanquer, M., García-Hernández, A., Castellanos, G., & Moraleda, J. (2014). Amniotic membrane-derived stem cells: immunomodulatory properties and potential clinical application. Stem Cells and Cloning: Advances and Applications, 7, 53 - 63. DOI:https://doi.org/10.2147/SCCAA.S58696.
Insausti, C. L., Rodríguez, M., Castellanos, G., & Moraleda, J. M. (2014). Propiedades inmunomoduladoras de las células madre de la membrana amniótica.
Nuevas perspectivas. Revista de Hematología, 15(1), 11-20.
Jafari, A., Niknejad, H., Rezaei-Tavirani, M., & Zali, H. (2020). The biological mechanism involved in anticancer properties of amniotic membrane. Oncology Reviews, 14.DOI: https://doi.org/10.4081/oncol.2020.429.
Koizumi, N. J., et al. (2000). Growth factor mRNA and protein in preserved human amniotic membrane. Current Eye Research, 20(3), 173-177.
Koob, T. J., et al. (2015). Amnion-derived cellular cytokine solution: A potential therapeutic agent for regenerative medicine. Journal of Orthopaedic Research, 33(6), 882-890.
Krajewska-Węglewicz, L. (2024). Applications of Amniotic Membrane in Ophthalmology – New Perspectives in the Treatment of Eye Diseases. Ophthalmology. DOI:https://doi.org/10.5114/oku/191664.
Lee, S. B., & Tseng, S. C. (1997). Amniotic membrane transplantation for persistent epithelial defects with ulceration. American Journal of Ophthalmology, 123(3), 303-312.
Laboratorio de Hemoderivados – Universidad Nacional de Córdoba. (2024). Vademécum UNC Biotecnia. Recuperado de:https://unc-hemoderivados.com.ar/wp-content/blogs.dir/95/files/sites/95/2024/06/UNC-Biotecnia-Vademecum.pdf
Lacorzana, J. (2020). Membrana amniótica, aplicaciones clínicas e ingeniería tisular. Revisión de su uso oftalmológico. Archivos de La Sociedad Española de Oftalmología, 95(1), 15-23.
Ilic, D., Vićovac, L., Nikolic, M., & Ilić, E. (2016). Human amniotic membrane grafts in therapy of chronic non-healing wounds. British medical bulletin, 117 1, 59-67. DOI:https://doi.org/10.1093/bmb/ldv053.
Mamede, A., Carvalho, M., Abrantes, A., Laranjo, M., Maia, C., & Botelho, M. (2012). Amniotic membrane: from structure and functions to clinical applications. Cell and Tissue Research, 349, 447 - 458. DOI:https://doi.org/10.1007/s00441-012-1424-6.
Ministerio de Salud de la Provincia de Córdoba. (2024, septiembre 30). El Banco Multitejidos alcanzó las 500 donaciones de placenta. Web de Noticias - Gobierno de Córdoba. Recuperado de:https://prensa.cba.gov.ar/salud-2/el-banco-multitejidos-alcanzo-las-500-donaciones-de-placenta/
Muñoz-Torres, J., Martínez-González, S., Lozano-Luján, A., Martínez-Vázquez, M., Velasco-Elizondo, P., Garza-Veloz, I., & Martinez-Fierro, M. (2023). Biological properties and surgical applications of the human amniotic membrane. Frontiers in Bioengineering and Biotechnology, 10. DOI:https://doi.org/10.3389/fbioe.2022.1067480.
Murphy, S. V., et al. (2010). Amnion-based matrices for tissue engineering applications. Stem Cell Research & Therapy, 1(3), 20.
Nejad, A., Hamidieh, A., Amirkhani, M., & Sisakht, M. (2020). Update review on five top clinical applications of human amniotic membrane in regenerative medicine. Placenta, 103, 104-119. DOI:https://doi.org/10.1016/j.placenta.2020.10.026.
Niknejad, H., et al. (2008). Properties of the amniotic membrane for potential use in tissue engineering. European Cells & Materials, 15, 88-99.
Piñera Martínez, M., Rodríguez Santiesteba, O., & Del Valle Piñera, S. (2020). Utilidad de la membrana amniótica en el proceso de cicatrización. Medisan, 24(4), 700-706.
Pipino, C., Bernabé-García, Á., Cappellacci, I., Stelling-Férez, J., Di Tomo, P., Santalucia, M., Navalón, C., Pandolfi, A., & Nicolás, F. (2022). Effect of the Human Amniotic Membrane on the Umbilical Vein Endothelial Cells of Gestational Diabetic Mothers: New Insight on Inflammation and Angiogenesis. Frontiers in Bioengineering and Biotechnology, 10.DOI: https://doi.org/10.3389/fbioe.2022.854845
Riboh, J., Saltzman, B., Yanke, A., & Cole, B. (2016). Human Amniotic Membrane–Derived Products in Sports Medicine. The American Journal of Sports Medicine, 44, 2425 - 2434.DOI: https://doi.org/10.1177/0363546515612750.
Richardson, L., Jeong, S., Kim, S., Hart, A., & Menon, R. (2019). Amnion membrane organ‐on‐chip: an innovative approach to study cellular interactions. The FASEB Journal, 33, 8945 - 8960.DOI: https://doi.org/10.1096/fj.201900020RR.
Rossi, D., Pianta, S., Magatti, M., Sedlmayr, P., & Parolini, O. (2012). Characterization of the Conditioned Medium from Amniotic Membrane Cells: Prostaglandins as Key Effectors of Its Immunomodulatory Activity. PLoS ONE, 7. DOI:https://doi.org/10.1371/journal.pone.0046956.
Shapira, V. (2002, noviembre 18). Primer banco de membrana amniótica en un hospital público. La Nación. Recuperado de [actualizado el 2020, junio 16]:https://www.lanacion.com.ar/ciencia/primer-banco-de-membrana-amniotica-en-un-hospital-publico-nid450878/
Sippel, K., J.K., J., & Foster, S. (2001). Amniotic membrane surgery. Current opinion in ophthalmology, 12 4, 269-81. DOI:https://doi.org/10.1097/00055735-200108000-00006.
Srinivasan, P., et al. (2021). Intra-articular injection of amniotic membrane-derived products for knee osteoarthritis: A systematic review. Arthroscopy, Sports Medicine, and Rehabilitation, 3(1), e97-e105.
Tehrani, F., Firouzeh, A., Shabani, I., & Shabani, A. (2021). A Review on Modifications of Amniotic Membrane for Biomedical Applications. Frontiers in Bioengineering and Biotechnology, 8.DOI: https://doi.org/10.3389/fbioe.2020.606982.
Tseng, S., Espana, E., Kawakita, T., Di Pascuale, M., Li, W., He, H., Liu, T., Cho, T., Gao, Y., Yeh, L., & Liu, C. (2004). How does amniotic membrane work?. The ocular surface, 2 3, 177-87. DOI:https://doi.org/10.1016/S1542-0124(12)70059-9.
Tseng, S. C. G., et al. (2004). Amniotic membrane transplantation. Ophthalmology Clinics of North America, 17(1), 1-11.
Universidad Nacional de Córdoba (2025). Portal del Laboratorio de Hemoderivados. Recuperado de: https://unc-hemoderivados.com.ar/project/matriz-osea-unc-en-membrana/

